
- •Лекция 21-23. Коррозия металлов и методы защиты металлов от коррозии введение
- •Основы теории коррозии
- •Подвод коррозионной среды или отдельных ее компонентов к поверхности металла.
- •Взаимодействие среды с металлом.
- •Полный или частичный отвод продуктов от поверхности металла (в объем жидкости, если среда жидкая).
- •Сущность процессов коррозии
- •Классификация коррозионных процессов
- •Механизмы коррозии
- •Термодинамика коррозионных процессов
- •Кинетика коррозионных процессов
- •Способы количественнной оценки скорости коррозии
- •Классификация коррозионных сред
- •Химическая коррозия
- •Коррозия металлов в жидкостях - неэлектролитах
- •Газовая коррозия
- •Электрохимическая коррозия
- •1. Гальванокоррозия.
- •Пассивация металлов
- •Защита металлов от коррозии
- •2. Защитные покрытия
- •Ингибиторы
- •Экологические аспекты коррозии и защиты металлов
- •1) Собственно экологический, вызванный нарушением биологического равновесия в природе при глобальных масштабах загрязнения окружающей среды;
- •2) Технико-экономический, связанный с истощением природных ресурсов.
- •Применение противокоррозионных защитных покрытий
- •Ответы на вопросы
1. Гальванокоррозия.
Гальванокоррозия вызывается многими причинами.
Основная причина возникновения гальванокоррозии - тесный контакт двух металлов с различными потенциалами, находящихся в среде электролита.
Металлы, находящиеся в тесном контакте (спай), образуют короткозамкнутый гальванический элемент.
Например, спай алюминия с медью.
По соотношению потенциалов алюминий является анодом, медь - катодом.
Рассмотрим данную гальванопару в кислой среде:
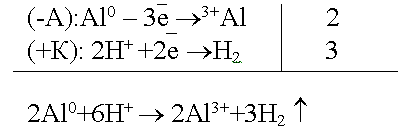
Разрушается анод, в данном случае алюминий.
Второй причиной возникновения гальванокоррозии является неоднородность металлов. Больше всего это относится к техническому железу - чугунам и сталям.
Техническое железо состоит в основном из кристаллов железа и участков цементита.
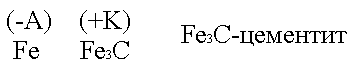
Кристаллы железа играют роль микроанодов, участки цементита - микрокатодов.
Рассмотрим данную систему в окружающей среде: воздухе с содержащейся в нём влагой (О2+2Н2О).
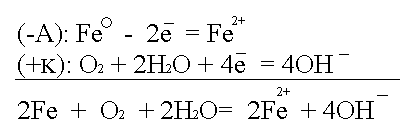
Следующей распространённой причиной возникновения гальванокоррозии является аэрация - неравномерный доступ кислорода (или воздуха) к разным участкам одного и того же металла.
Примером может служить вбитый во влажное дерево гвоздь. Та часть изделия (гвоздя), к которой доступ воздуха свободен, является катодом. Часть гвоздя, находящаяся в дереве, является анодом. Возникает коррозия:
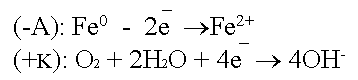
Почему гвоздь во влажной древесине доски ржавеет и через некоторое время полностью превращается в бурую непрочную массу (рис. 5)?

Рис. 5. Схема образования ржавчины на железном гвозде
В кристаллической решетке железа находятся ионы и электроны:
Fe (кр.) – 2е = Fe2+ (кр.).
Для электрохимической коррозии железа необходимы вода и кислород воздуха. Начало коррозии заложено в известном вам процессе самопроизвольного перехода ионов Fe2+ в раствор:
Fe (кр.) – 2e = Fe2+ (р-р).
Ионы Fe2+ диффундируют по влажной древесине и одновременно переходят в ионы Fe3+:
Fe2+ – е = Fe3+.
Этот переход совершается благодаря тому, что кислород воздуха, реагируя с водой, использует образовавшиеся электроны:
О2 + 2Н2О + 4е = 4ОН–.
Далее ионы Fe3+ образуют с ионами ОН– тригидроксид железа:
Fe3+ + 3ОН– = Fe(ОН)3.
Это самая примитивная схема ржавления железа. Одновременно протекают многочисленные параллельные и последовательные реакции. Ионы Fe2+ и Fe3+ гидролизуются с образованием основных ионов и гидроксидов Fe(ОН)2 и Fe(ОН)3. Гидроксид Fe(ОН)3 может быть представлен также формулой 2Fe(ОН)3 или Fe2О3•3Н2О. Это одна из формул вещества ржавчины. В действительности состав тригидроксида железа или гидратированного триоксида железа неопределенен: Fe2О3•nН2О.
К этим реакциям добавляются реакции гидроксидов и основных ионов с углекислым газом, в результате чего образуются основные соли железа типа Fe(ОН)СО3 или (Fе(ОН)2)2СО3.
Приведенные выше реакции взаимосвязаны, и все смещают равновесие перехода ионов железа в раствор.
Суммарно и приближенно процесс ржавления железа может быть выражен следующим уравнением:
4Fe +2H2O + 3O2 = 2(Fe2О3•Н2О) (ржавчина).
На скорость коррозии существенное влияние оказывает концентрация ионов H+. Повышение pH приводит к замедлению коррозии, поскольку восстановление O2 из H2O замедляется. При pH = 9–10 коррозия железа практически прекращается (рис. 6):
4Fe2+ + O2 + 4H2O + xH2O = 2Fe2O3∙xH2O + 8H+.
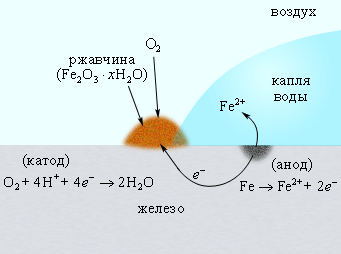
Рисунок 6.
Коррозия железа кислородом воздуха, растворенным в воде.
2. Электрокоррозия - это коррозия материалов под влиянием электрического тока от внешнего источника (коррозия блуждающих токов).
Источниками блуждающих токов являются:
весь электротранспорт,
электроаппараты, работающие на земле.
Поток электронов, идущий по рельсу, встречая какое -- либо омическое сопротивление, например стык, уходит в почву. Этот участок рельса становился катодом по отношению к близко расположенному участку трубопровода.
Почва по своему составу является прекрасным проводником электронов. В почве такой поток электронов может пройти десятки километров. На своём пути поток электронов встречает какой-либо металлический предмет, например, трубопровод, и входит в него.
Данный участок трубопровода становится анодом и начинает разрушаться:

Ионы Fe уходят в землю, а поток электронов направляется далее по трубопроводу до тех пор, пока не встретит какое-либо новое сопротивление.
Встретив сопротивление, электроны уходят в землю, превращая данный участок трубопровода в катод. Поток электронов может войти в тот же рельс, откуда он вышел, превращая его в анод. Катодный процесс зависит от состава почвы.
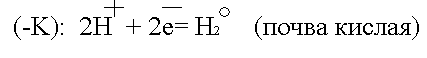
или
![]() .
.
Итак, процессы электрохимической коррозии протекают по законам электрохимической кинетики, когда общая реакция взаимодействия может быть разделена на следующие, в значительной степени самостоятельные, электродные процессы:
анодный процесс - переход металла в раствор в виде ионов (в водных растворах, обычно гидратированных) с оставлением эквивалентного количества электронов в металле;
катодный процесс - ассимиляция появившихся в металле избыточных электронов деполяризаторами.
Так же различают следующие типы электрохимической коррозии , имеющие наиболее важное практическое значение.
1. Коррозия в электролитах. К этому типу относятся коррозия в природных водах (морской и пресной), а также различные виды коррозии в жидких средах. В зависимости от характера среды различают:
а) кислотную ;
б) щелочную ;
в) солевую ;
г) морскую коррозию.
По условиям воздействия жидкой среды на металл этот тип коррозии также характеризуется как:
коррозия при полном погружении;
при неполном погружении;
при переменном погружении.
Каждый из этих подтипов имеет свои характерные особенности.
2 . Почвенная (грунтовая, подземная) коррозия - воздействие на металл грунта, который в коррозионном отношении должен рассматриваться как своеобразный электролит.
Характерной особенностью подземной электрохимической коррозии является большое различие в скорости доставки кислорода (основной деполяризатор) к поверхности подземных конструкций в разных почвах (в десятки тысяч раз). Значительную роль при коррозии в почве играет образование и функционирование макрокоррозионных пар вследствие неравномерной аэрации отдельных участков конструкции, а также наличие в земле блуждающих токов. В ряде случаев на скорость электрохимической коррозии в подземных условиях оказывает существенное влияние также развитие биологических процессов в почве.
3. Атмосферная коррозия - коррозия металлов в условиях атмосферы, а также любого влажного газа; наблюдается под конденсационными видимыми слоями влаги на поверхности металла (мокрая атмосферная коррозия) или под тончайшими невидимыми адсорбционными слоями влаги (влажная атмосферная коррозия).
Особенностью атмосферной коррозии является сильная зависимость ее скорости и механизма от толщины слоя влаги на поверхности металла или степени увлажнения образовавшихся продуктов коррозии.
4. Коррозия в условиях механического воздействия. Этому типу разрушения подвергаются многочисленные инженерные сооружения, работающие как в жидких электролитах, так и в атмосферных и подземных условиях. Наиболее типичными видами подобного разрушения являются:
Коррозионное растрескивание; при этом характерно образование трещин, которые могут распространяться не только межкристально, но также и транскристально. Примером подобного разрушения является щелочная хрупкость котлов, сезонное растрескивание латуней, а также растрескивание некоторых конструкционных высокопрочных сплавов.
Коррозионная усталость, вызываемая воздействием коррозионной среды и знакопеременных или пульсирующих механических напряжений. Этот вид разрушения также характеризуется образованием меж- и транскристаллитных трещин. Разрушения металлов от коррозионной усталости встречаются при эксплуатации различных инженерных конструкций (валов гребных винтов, рессор автомобилей, канатов, штанг глубинных насосов, охлаждаемых валков прокатных станов и др.).
Коррозионная кавитация, являющаяся обычно следствием энергичного механического воздействия коррозионной среды на поверхность металла. Подобное коррозионно-механическое воздействие может приводить к весьма сильным местным разрушениям металлических конструкций (например, для гребных винтов морских судов). Механизм разрушения от коррозионной кавитации близок к разрушению от поверхностной коррозионной усталости.
Коррозионная эрозия, вызываемая механическим истирающим воздействием другого твердого тела при наличии коррозионной среды или непосредственным истирающим действием самой коррозионной среды. Это явление иногда называют также коррозионным истиранием или фреттинг-коррозией.
