
- •Лекция 21-23. Коррозия металлов и методы защиты металлов от коррозии введение
- •Основы теории коррозии
- •Подвод коррозионной среды или отдельных ее компонентов к поверхности металла.
- •Взаимодействие среды с металлом.
- •Полный или частичный отвод продуктов от поверхности металла (в объем жидкости, если среда жидкая).
- •Сущность процессов коррозии
- •Классификация коррозионных процессов
- •Механизмы коррозии
- •Термодинамика коррозионных процессов
- •Кинетика коррозионных процессов
- •Способы количественнной оценки скорости коррозии
- •Классификация коррозионных сред
- •Химическая коррозия
- •Коррозия металлов в жидкостях - неэлектролитах
- •Газовая коррозия
- •Электрохимическая коррозия
- •1. Гальванокоррозия.
- •Пассивация металлов
- •Защита металлов от коррозии
- •2. Защитные покрытия
- •Ингибиторы
- •Экологические аспекты коррозии и защиты металлов
- •1) Собственно экологический, вызванный нарушением биологического равновесия в природе при глобальных масштабах загрязнения окружающей среды;
- •2) Технико-экономический, связанный с истощением природных ресурсов.
- •Применение противокоррозионных защитных покрытий
- •Ответы на вопросы
2. Защитные покрытия
Одним из наиболее распространенных способов защиты металлов от коррозии является нанесение на их поверхность защитных пленок.
а) Неметаллические - лаки, краски, резина, керамика. Основные требования к неметаллическим покрытиям: доступность, дешевизна, экологическая безопасность.
Лакокрасочные покрытия наиболее доступны для широкого круга людей. Лаки и краски обладают низкой газо- и паропроницаемостью, водоотталкивающими свойствами, поэтому они препятствуют доступу к поверхности металла воды, кислорода и содержащихся в атмосфере агрессивных компонентов.
Покрытие поверхности металла лакокрасочным слоем не исключает коррозию, а служит для нее лишь преградой, а значит, лишь тормозит процесс коррозии. Именно поэтому важное значение имеет качество покрытия – толщина слоя, пористость, равномерность, проницаемость, способность набухать в воде, прочность сцепления (адгезия).
Качество покрытия зависит от тщательности подготовки поверхности и способа нанесения защитного слоя. Окалина и ржавчина должны быть удалены с поверхности покрываемого металла. В противном случае они будут препятствовать хорошей адгезии покрытия с поверхностью металла. Низкое качество покрытия нередко связано с повышенной пористостью. Часто она возникает в процессе формирования защитного слоя в результате испарения растворителя и удаления продуктов отверждения и деструкции (при старении пленки). Поэтому обычно рекомендуют наносить не один толстый слой, а несколько тонких слоев покрытия. Во многих случаях увеличение толщины покрытия приводит к ослаблению адгезии защитного слоя с металлом. Большой вред наносят воздушные полости, пузыри. Они образуются при низком качестве выполнения операции нанесения покрытия.
Для снижения смачиваемости водой лакокрасочные покрытия иногда, в свою очередь, защищают восковыми составами или кремнийорганическими соединениями. Лаки и краски наиболее эффективны для защиты от атмосферной коррозии. В большинстве случаев они непригодны для защиты подземных сооружений и конструкций, так как трудно предупредить механические повреждения защитных слоев при контакте с грунтом. Опыт показывает, что срок службы лакокрасочных покрытий в этих условиях невелик. Намного практичнее оказалось применять толстослойные покрытия из каменноугольной смолы (битума).
В некоторых случаях пигменты красок выполняют также роль ингибиторов коррозии. К числу таких пигментов относятся хроматы стронция, свинца и цинка (SrCrO4 , PbCrO4 , ZnCrO4 ).
Грунтовки и фосфатирование
Часто под лакокрасочный слой наносят грунтовки. Пигменты, входящие в ее состав, также должны обладать ингибиторными свойствами. Проходя через слой грунтовки, вода растворяет некоторое количество пигмента и становится менее коррозионноактивной. Среди пигментов, рекомендуемых для грунтов, наиболее эффективным признан свинцовый сурик Pb3O4 .
Вместо грунтовки иногда проводят фосфатирование поверхности металла. Для этого на чистую поверхность кистью или распылителем наносят растворы ортофосфатов железа (III), марганца (II) или цинка (II), содержащих и саму ортофосфорную кислоту H3PO4 . В заводских условиях фосфатирование ведут при 99-97 0 С в течение 30-90 минут. В образование фосфатного покрытия вносят вклад металл, растворяющийся в фосфатирующейся смеси, и оставшиеся на его поверхности оксиды.
Фосфотирование производят из смеси, например,
ZnHPO4 + фосфорная кислота
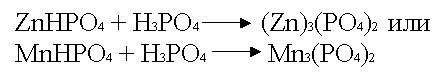 .
.
Эти фосфатные пленки имеют хорошее прочное сцепление с техническим железом (сталь, чугун). Но поскольку пленки пористые, сами по себе они изделия от коррозии не защищают. В этом случае применяется дополнительная защита - краска. В соединении с краской защита очень надежна.
Для фосфатирования поверхности стальных изделий разработано несколько различных препаратов. Большинство из них состоят из смеси фосфатов марганца и железа. Возможно, наиболее распространенным препаратом является “мажеф” – смесь дигидрофосфатов марганца Mn(H2 PO4 )2 , железа Fe(H2PO4 )2 и свободной фосфорной кислоты. Название препарата состоит из первых букв компонентов смеси. По внешнему виду мажеф – это мелкокристаллический порошок белого цвета с соотношением между марганцем и железом от 10:1 до 15:1. Он состоит из 46-52 % P2O5; не менее 14 % Mn; 0,3-3 % Fe. При фосфатировании мажефом стальное изделие помещается в его раствор, нагретый примерно до 1000С. В растворе происходит растворение с поверхности железа с выделением водорода, а на поверхности образуется плотный, прочный и малорастворимый в воде защитный слой фосфатов марганца и железа серо-черного цвета. При достижении толщины слоя определенной величины дальнейшее растворение железа прекращается.
Пленка фосфатов защищает поверхность изделия от атмосферных осадков, но мало эффективна от растворов солей и даже слабых растворов кислот. Таким образом, фосфатная пленка может служить лишь грунтом для последовательного нанесения органических защитных и декоративных покрытий – лаков, красок, смол. Процесс фосфатирования длится 40-60 минут. Для его ускорения в раствор вводят 50-70 г/л нитрата цинка. В этом случае время сокращается в 10-12 раз.
Оксидирование стали (воронение)
На стали получают оксидную пленку сложного состава
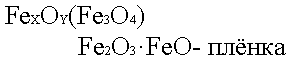
Эта пленка интенсивно черного цвета, отсюда и название - воронение.
Структура
пленки - плотная, беспористая, сцепление
её с металлом очень прочное. При толщине
пленки в 30-40
![]() она
надежно защищает изделия от коррозии.
она
надежно защищает изделия от коррозии.
Силикатные покрытия
Для защиты металлов от коррозии используют стекловидные и фарфоровые эмали, коэффициент теплового расширения которых должен быть близок к таковому для покрываемых металлов.
Эмалирование осуществляют нанесением на поверхность изделий водной суспензии или сухим напудриванием.
Вначале на очищенную поверхность наносят грунтовочный слой и обжигают его в печи. Далее наносят слой покровной эмали и обжиг повторяют. Наиболее распространены стекловидные эмали – прозрачные или загашенные. Их компонентами являются SiO2 (основная масса), B2O3, Na2O, PbO. Кроме того, вводят вспомогательные материалы: окислители органических примесей, оксиды, способствующие сцеплению эмали с эмалируемой поверхностью, глушители, красители. Эмалирующий материал получают сплавлением исходных компонентов, измельчением в порошок и добавлением 6-10 % глины. Эмалевые покрытия в основном наносят на сталь, а также на чугун, медь, латунь и алюминий.
Эмали обладают высокими защитными свойствами, которые обусловлены их непроницаемостью для воды и воздуха (газов) даже при длительном контакте.
Их важным качеством является высокая стойкость при повышенных температурах.
К основным недостаткам эмалевых покрытий относят чувствительность к механическим и термическим ударам. При длительной эксплуатации на поверхности эмалевых покрытий может появиться сетка трещин, которая обеспечивает доступ влаги и воздуха к металлу, вследствие чего и начинается коррозия.
Цементные покрытия
Для защиты чугунных и стальных водяных труб от коррозии используют цементные покрытия. Поскольку коэффициенты теплового расширения портландцемента и стали близки, то он довольно широко применяется для этих целей. Недостаток портландцементных покрытий тот же, что и эмалевых, – высокая чувствительность к механическим ударам.
б) Металлические покрытия
Широко распространенным способом защиты металлов от коррозии является покрытие их слоем других металлов. Покрывающие металлы сами корродируют с малой скоростью, так как покрываются плотной оксидной пленкой.
Покрывающий слой наносят различными методами:
горячее покрытие – кратковременное погружение в ванну с расплавленным металлом;
гальваническое покрытие – электроосаждение из водных растворов электролитов;
металлизация – напыление;
диффузионное покрытие – обработка порошками при повышенной температуре в специальном барабане;
с помощью газофазной реакции, например:
В зависимости от требований предъявляемых к покрытиям, различают три типа покрытий:
Защитные покрытия, применяемые для защиты от коррозии металлических изделий. Наиболее распространенные цинковые, кадмиевые, хромовые и никелевые покрытия.
Защитно-декоративные покрытия, применяемые для декоративной отделки изделий с одновременной защитой их от коррозии (например никелевые покрытия).
Специальные покрытия, применяемые для придания поверхности изделия специальных свойств (износостойкости, пояемости, придания антифрикционных свойств, отражательной способности и др.) Например, нанесение хрома для увеличения износостойкости.
По характеру защитного действия можно разделить на анодные и катодные.
Анодные покрытия имеют более отрицательный электродный потенциал по сравнению с защищаемым металлом, и в случае возникновения условий для электрохимической коррозии разрушаться будет покрытие, т.к. оно будет выполнять роль анода.
Для
покрытия выбирается металл практически
не коррозирующий в тех же условиях (![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() и др.).
и др.).
Например, относительно стали (Fe2+, 0 = - 0,44 В), анодным будет цинковое (Zn2+, 0 = - 0,76 В) покрытие.
Оцинкованное железо. Цинк выполняет роль анода, то его защитная функция сохраняется и при нарушении цинкового покрытия (рис. 7).
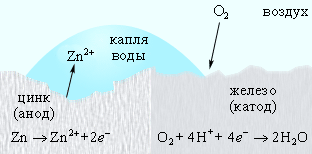
Рисунок 7.
Катодная защита в оцинкованном железе.
При нарушении целостности такого покрытия образуется гальванопара, в которой анодом является металл покрытия, и он будет разрушаться, предохраняя основной металл. Например:
![]()
А:
![]() - окисление.
- окисление.
К:
![]() - восстановление.
- восстановление.
Железо в контакте с цинком или покрытое им (оцинкованное железо) не подвергается коррозии в связи с тем, что в образующемся гальваническом элементе растворяется цинк, а на железе выделяется водород.
Из справочных данных:
![]()
следует, что цинк по сравнению с железом обладает большей способностью к передаче ионов в раствор:

Цинк будет реагировать с ионами железа, если они образуются при коррозии, и будет выделяться металлическое железо. Другими словами, цинк смещает равновесие между железом и его ионами в сторону металлического железа.
Цинк в контакте с железом растворяется в водной среде, а образовавшийся отрицательный заряд в виде электронов переходит на железо.
Возникающая повышенная концентрация электронов в железе препятствует его переходу в виде ионов в раствор, т.е. защищает его от коррозии. В результате благодаря реакции с водой на железе выделяется водород:
2Н2О + 2е = Н2 + 2ОН–.
Цинк, защищая железо от коррозии, переходит в гидроксид цинка:
Zn2+ + 2ОН– = Zn(ОН)2.
Поэтому железо с цинком имеет белый налет – слой или даже скопления гидроксида цинка (или оксида цинка).
Еще примером анодного покрытия может служить хром, нанесенный на железо. В случае нарушения целостности покрытия при контакте с влажным воздухом будет работать гальванический элемент:
А (–) Cr H2O, O2 Fe (+) К
на аноде: Cr – 2e Cr2+
на катоде: 2 H2O + O2 + 4e 4 OH–
Cr2+ + 2 OH– Cr(OH)2
Гидроксид хрома (II) окисляется кислородом воздуха до Cr(OH)3:
4 Cr(OH)2 + 2H2O + O2 4 Cr(OH)3
Таким образом, в результате электрохимической коррозии разрушается анодное покрытие.
Защитные свойства таких покрытий в меньшей степени зависят от качества нанесения и состояния пленки покрытия. Анодные покрытия защищают изделие механически и электрически.
Катодные покрытия имеют более положительный электродный потенциал по сравнению с основным металлом.
Пока слой покрытия изолирует металл от окружающей среды, электрохимическая коррозия не протекает. При нарушении сплошности катодного покрытия оно перестает защищать металл от коррозии. Более того, оно даже интенсифицирует коррозию основного металла, т.к. в возникающей гальванопаре анодом служит основной металл, который будет разрушаться.
Например, относительно стали (Fe2+, 0 = -0,44 В), катодным будет медное (Cu2+, 0 = 0,34 В) покрытие.
При нарушении целостности такого покрытия образуется гальванопара, в которой металл покрытия является катодом, а анодом - основной металл. Например:
![]()
А:
![]() - окисление.
- окисление.
К:
![]() - восстановление.
- восстановление.
![]()
Железо разрушается.
В качестве примера можно привести оловянное покрытие на железе (луженое железо). Рассмотрим работу гальванического элемента, возникающего в этом случае.
А (–) Fe H2O, O2 Sn (+) К
на аноде: Fe – 2e Fe2+
на катоде: 2 H2O + O2 + 4e 4 OH–
Fe2+ + 2 OH– Fe(OH)2
Появление в железе трещин и царапин способствует проникновению влаги и воздуха к поверхности железа, и процесс коррозии возобновляется, причем в случае оловянного покрытия он даже ускоряется, поскольку олово служит катодом в электрохимическом процессе (рис. 8).
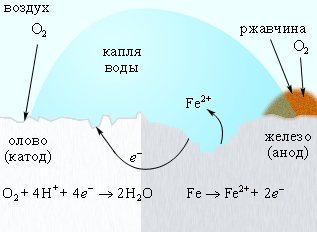
Рисунок 8.
Коррозия «белой жести».
Разрушается защищаемый металл.
Таким образом, при сравнении свойств анодных и катодных покрытий можно сделать вывод, что наиболее эффективными являются анодные покрытия. Они защищают основной металл даже в случае нарушения целостности покрытия, тогда как катодные покрытия защищают металл лишь механически.
При некачественном нанесении (поры, оголенные участки) или механическом нарушении (царапины, трещины) защитного слоя идет усиленное разрушение металла.
В повседневной жизни человек чаще всего встречается с покрытиями железа цинком и оловом.
Листовое железо, покрытое цинком, называют оцинкованным железом, а покрытое оловом – белой жестью.
Первое в больших количествах идет на кровли домов, а второе – на изготовление консервных банок.
Впервые способ хранения пищевых продуктов в жестяных банках предложил повар Н.Ф. Аппер в 1810 году. И то, и другое железо получают, главным образом, протягиванием листа железа через расплав соответствующего металла.
3. Электрохимическая защита. Различают два вида электрохимической защиты: катодная и протекторная.
В обоих случаях создаются условия для возникновения на защищаемом металле высокого электроотрицательного потенциала.
Т.е. к защищаемому изделию подключается протектор - кусок металла, имеющий более отрицательное значение стандартного электродного потенциала, чем, металл защищаемого изделия. При воздействии агрессивной среды в первую очередь разрушается протектор.
Протекторная защита. Защищаемое от коррозии изделие соединяют с металлическим ломом из более электроотрицательного металла (протектора). Это равносильно созданию гальванического элемента, в котором протектор является анодом и будет разрушаться.
Например, для защиты подземных сооружений (трубопроводов) на некотором расстоянии от них закапывают металлолом (протектор), присоединив его к сооружению (рисунок 9).
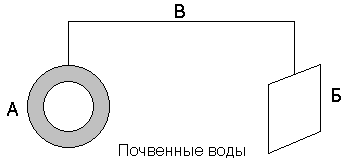
Рисунок 9. – Схема протекторной защиты.
А – трубопровод; Б – протектор; В – проводник
Катодная защита отличается от протекторной тем, что защищаемая конструкция, находящаяся в электролите (почвенная вода), присоединяется к катоду внешнего источника тока. В ту же среду помещают кусок металлолома, который соединяют с анодом внешнего источника тока (рисунок 10).
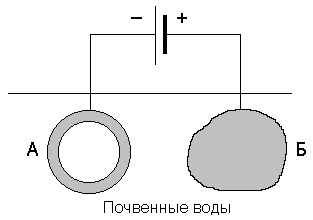
Рисунок 10. – Схема катодной защиты.
А – конструкция; Б – протектор
Металлический лом подвергается разрушению, предохраняя тем самым от разрушения защищаемую конструкцию.
Во многих случаях металл предохраняет от коррозии образующаяся на его поверхности стойкая оксидная пленка (так, на поверхности алюминия образуется Al2O3, препятствующий дальнейшему окислению металла). Однако некоторые ионы, например Cl–, разрушают такие пленки и тем самым усиливают коррозию.
Недостатком этого метода является расход электроэнергии.
Катодная защита защищаемое изделие подключают в источнику внешнего тока таким образом, чтобы оно стало катодом. В таком случае процесс коррозии на изделии подавляется вовсе.
Анодная защита защищаемое изделие подключается к источнику внешнего тока таким образом, чтобы оно стало анодом и устанавливают такое напряжение, которое соответствует зоне пассивации на анодной поляризационной кривой. Поверхность защищаемого изделия пассивируется и процесс коррозии прекращается.
4. Изменение среды. (Обработка внешней среды, в которой протекает коррозия).
Сущность метода заключается либо в удалении из окружающей среды тех веществ, которые выполняют роль деполяризатора, либо в изоляции металла от деполяризатора.
Например, для удаления из воды кислорода используют специальные вещества или кипячение.
Удаление кислорода из коррозионной среды называется деаэрацией.
Максимально замедлить процесс коррозии можно путем введения в окружающую среду специальных веществ – ингибиторов. Широкое распространение получили летучие и парофазные ингибиторы, которые защищают от атмосферной коррозии изделия из черных и цветных металлов при хранении, транспортировке и т.д. Механизм действия ингибиторов заключается в том, что их молекулы адсорбируются на поверхности металла, препятствуя протеканию электродных процессов.
