
- •Лекция 21-23. Коррозия металлов и методы защиты металлов от коррозии введение
- •Основы теории коррозии
- •Подвод коррозионной среды или отдельных ее компонентов к поверхности металла.
- •Взаимодействие среды с металлом.
- •Полный или частичный отвод продуктов от поверхности металла (в объем жидкости, если среда жидкая).
- •Сущность процессов коррозии
- •Классификация коррозионных процессов
- •Механизмы коррозии
- •Термодинамика коррозионных процессов
- •Кинетика коррозионных процессов
- •Способы количественнной оценки скорости коррозии
- •Классификация коррозионных сред
- •Химическая коррозия
- •Коррозия металлов в жидкостях - неэлектролитах
- •Газовая коррозия
- •Электрохимическая коррозия
- •1. Гальванокоррозия.
- •Пассивация металлов
- •Защита металлов от коррозии
- •2. Защитные покрытия
- •Ингибиторы
- •Экологические аспекты коррозии и защиты металлов
- •1) Собственно экологический, вызванный нарушением биологического равновесия в природе при глобальных масштабах загрязнения окружающей среды;
- •2) Технико-экономический, связанный с истощением природных ресурсов.
- •Применение противокоррозионных защитных покрытий
- •Ответы на вопросы
Механизмы коррозии
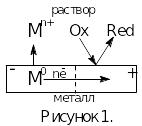
Рассмотрим работу локального микрогальванического элемента на поверхности металла (рис.1). На участке поверхности металла, обладающим более отрицательным значением потенциала (анод), идет реакция растворения металла, коррозия:
![]() (I)
(I)
На участке поверхности с более положительным потенциалом (катод) происходит реакция восстановления окислителя, содержащегося в электролите:
![]()
 ,
(II)
,
(II)
где Ox – окисленная форма; Red – восстановленная форма.
Вид катодного процесса зависит от вида среды (от вида окислителя). В природных условиях наиболее частыми катодными процессами являются:
а) в кислой среде (pH 7) при ограниченном доступе кислорода к металлу катодный процесс идет по схеме:
![]() .
.
Коррозионные процессы, сопровождающиеся восстановлением водорода, называются коррозией с водородной деполяризацией.
б) при большой скорости поступления кислорода в нейтральной (pH=7) или щелочной (pH7) средах преимущественным является другой процесс:
![]() .
.
В
слабокислой среде при условии хорошего
доступа кислорода процесс также идет
с поглощением кислорода. В этом случае
схема катодного процесса имеет следующий
вид:
![]()
Коррозионные процессы, сопровождающиеся восстановлением кислорода, называются коррозией с кислородной деполяризацией.
Процесс отвода электронов с катодных участков называется деполяризацией.
Вещества, при участии которых осуществляется деполяризация, называются деполяризаторами
Коррозия с кислородной деполяризацией наиболее распространенный тип коррозии металла в воде, в нейтральных и даже в слабокислых солевых растворах, в морской воде, в земле, в атмосфере воздуха.
Коррозия металла с кислородной деполяризацией в большинстве практических случаев происходит в электролитах, соприкасающихся с атмосферой, парциальное давление кислорода в которой равно 0,21 атм.
Каждый процесс с кислородной деполяризацией включает следующие последовательные стадии.
Растворение кислорода в электролите.
Транспортировка растворенного кислорода в растворе электролита (за счет диффузии или перемешивания).
Перенос кислорода в результате движения электролита.
Перенос кислорода в диффузионном слое электролита или в пленке продуктов коррозии металла к катодным участкам поверхности.
Ионизация кислорода:
В реальных условиях коррозии металла наиболее затрудненными стадиями процесса являются:
Реакция ионизации кислорода на катоде. Возникающую при этом поляризацию называют перенапряжением кислорода. Говорят, что процесс идет с кинетическим контролем.
Диффузия кислорода к катоду, либо перенапряжение диффузии. В этом случае, говорят, что процесс идет с диффузионным контролем.
Возможны случаи, когда обе стадии – ионизация кислорода и диффузия кислорода оказывают влияние на процесс. Тогда говорят, о кинетически-диффузионном контроле.
Основной электрохимический механизм коррозии может иметь варианты. Анодная реакция при n 2 может протекать через одноэлектронные стадии. Так при n = 2 могут иметь место следующие процессы:
![]()
Катион в промежуточной степени окисления M+ в некоторых случаях настолько устойчив, что может вступать в химическую реакцию с окислителем прежде, чем успевает произойти его электрохимическое анодное доокисление:
![]() (III)
(III)
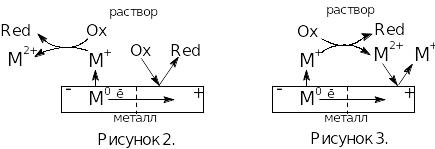
В этом случае говорят об электрохимическо-химическом механизме коррозии. Схема этого процесса представлена на рисунке 2.
Е ще
одной разновидностью электрохимического
механизма коррозии является так
называемый каталитический
механизм
(рис.3). Он очень напоминает предыдущий
механизм коррозии и отличается от него
тем, что протекающая очень быстро реакция
(III)
препятствует поступлению окислителя
к поверхности металла. В результате в
катодном процессе восстанавливаются
катионы металла (при
n=2
-
ще
одной разновидностью электрохимического
механизма коррозии является так
называемый каталитический
механизм
(рис.3). Он очень напоминает предыдущий
механизм коррозии и отличается от него
тем, что протекающая очень быстро реакция
(III)
препятствует поступлению окислителя
к поверхности металла. В результате в
катодном процессе восстанавливаются
катионы металла (при
n=2
-
![]() ):
):
![]() .
.
Ионы
![]() в этом случае играют роль катализатора
процесса коррозии.
в этом случае играют роль катализатора
процесса коррозии.
В случае неэлектропроводящих сред (сухие газы, неэлектролиты) разрушение металлов происходит по химическому механизму. В соответствии с этим механизмом передача всех n электронов от металла к окислителю происходит непосредственно в одном элементарном акте. Наиболее важным коррозионным процессом, протекающим по химическому механизму, является газовая коррозия.
На рисунке 4 приведена схема газовой коррозии в среде кислорода. В общем виде уравнение реакции можно записать так:
![]() .
.
Окисление металлов – процесс многостадийный. В результате взаимодействия вначале на поверхности образуется моно-, а затем полимолекулярный слой оксидов. По мере утолщения пленки процессы встречной диффузии реагентов затрудняются. Образующаяся оксидная пленка будет тормозить дальнейшее развитие коррозионного процесса. Однако это будет происходить только в том случае, если пленка будет обладать защитными свойствами (см. ниже).
