
Подбор режима термической обработки.
Проводим закалку (1020-1100 0С) с охлаждением в масле, затем подвергаем холодной деформации.
Наилучшими кислотоупорными свойствами обладают стали с минимальным углеродом, но такую сталь трудно выплавить. Углерод провоцирует восприимчивость к межкристаллитной коррозии (разрушение по границам зерна, в результате структурных превращений), к коррозионному растрескиванию (одновременно коррозия и рабочее нагружение), и точечной коррозии (местное разрушение в неоднородной среде). Поскольку хром карбидообразователь, он стремиться образовать карбид, при этом нержавеющие свойства ухудшаются. С целью обеспечения максимально возможных нержавеющих свойств стали, её закаливают с целью растворения карбидов, перевода хром в раствор.
После закалки структура аустенит, сталь очень мягкая, с целью повышения твердости и прочности проводят наклеп, тогда прочность повышается почти в два раза при сохранении удовлетворительной пластичности. В результате наклепа произойдет понижение пластичности и кислотоупорности, но небольшое.
Упрочнение объясняется увеличением плотности дислокаций, закреплением их частицами второй фазы и атомами растворенных элементов в процессе последующего старения. Затруднению движения дислокаций способствуют также и препятствия в виде границ фрагментов (и различного характера субграницы).
Межкристаллитная коррозия (МКК) – один из видов местной коррозии металла, который приводит к избирательному разрушению границ зерна. Межкристаллитная коррозия – очень опасный вид разрушения, т.к. визуально ее не всегда можно определить. Металл теряет свою пластичность и прочность. Причиной склонности сплавов к межкристаллитной коррозии является электрохимическая неоднородность структуры сплава, когда границы зерен или приграничные зоны являются более электрохимически отрицательными по сравнению с зерном. Межкристаллитной коррозия возникает из-за структурных превращений на границах зерен металла. Зона структурных превращений становится анодом, который усиленно растворяется. Связь между зернами металла нарушается. Вследствии этих процессов металлические конструкции при эксплуатации теряют свои свойства и быстро приходят в негодность. Скорость протекания межкристаллитной коррозии определяется потенциалом металла.

Рисунок 21. Микроструктура материала, подверженного межкристаллитной коррозии
Структура и свойства стали
После термической обработки структура стали будет аустенит и карбиды.
Механические свойства:
Предел кратковременной прочности σв = 490 МПа.
Предел пропорциональности σт = 196 МПа.
Относительное удлинение при разрыве δ = 40%.
Расчетным путем температуру начала мартенситного превращения можно вычислить по формуле Попова:
Мн = 520 - 320·(%С) - 45·(%Mn) - 30·(%Cr) - 20·(%Ni + %Mo) - 5·(%Si + %Cu)
Для стали 03Х17Н15М3 если брать средние значения содержания легирующих элементов:
Мн = 520 - 320·0.03 - 45·0.15 - 30·17 - 20·(15 + 2.8) - 5·(0.4 + 0) ≈ -365° С
Приложение.
Сплавы у которых γ-состояние стабильно от комнатной температуры до температуры плавления называются аустенитными . Легирующие элементы которые расширяют γ-область и сужают α-область: Ni, Mn, N, C.
Сплавы у которых α-состояние стабильно от комнатной температуры до температуры плавления называются ферритными. Легирующие элементы которые наоборот расширяют α-область и сужают γ-область Cr, W, Mo, V, Ti, Si
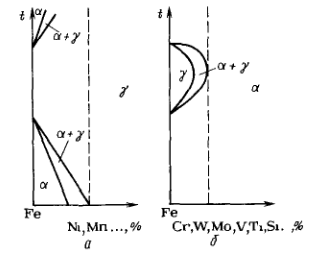
Рисунок 22. Влияние легирующих элементов на полиморфизм железа.
Хром: Хром возглавляет группу элементов расширяющих α-область, и сужающих γ-область. Чистый хром во всем интервале температур имеет кристаллическую решетку ОЦК. Параметр куба близок к параметру αFe а=2,8788кХ. Критические точки А4 А3 А1 понижаются. Двухфазная область замыкается при 13% хрома. α-раствор богатый хромом обнаруживает повышенную хрупкость, причем хрупкость настолько велика, что невозможно сделать шлиф. Хрупкость эта связана с образованием интерметаллида FeCr электронного типа, называемого σ-фазой. Образование σ-фазы сопровождается уменьшение обьема. Образование этой фазы протекает очень медленно, можно ускорить ее образование деформацией. Решетка σ-фазы тетрагональная, параметр ее а = 8.8 Å, с = 4.544 Å. σ-фаза образуется в интервале температур 600-800° С. С повышением температур фаза растворяется, а при более низкой температуре не может образоваться. В следствии высокой хрупкости σ-фаза является нежелательной структурной составляющей, хотя в некоторых случаях повышения твердости и износостойкости может оказаться полезной, но если изделие работает под напряжением, то материал σ-фазы оказывается чувствительным к растрескиванию. В ферритных и полуферритных сплавах содержащих от 12 до 70% в результате длительных нагревов в область температур 400-500 0С происходит повышение твердости, повышается точка Кюри, снижается электропроводность, сплавы также охрупчиваются. Эту хрупкость назвали 475 градусной хрупкостью. Если нагреем выше температуры 500-600 0С хрупкость пропадет.

Рисунок 23. Диаграмма состояния системы Fe-C.
Тройная диаграмма Fe-C-Cr очень сложна, это вызвано тем что Cr карбидообразующий элемент растворяющийся в цементите и образующий два собственных специальных корбида. Чем больше в стали Cr и меньше C тем боьшая вероятность образования карбида Cr 7C3 , этот карбид может растворять в себе от 30 до 50% Fe. При большом количестве Cr может образовываться Cr 23C6 и Fe там до 25%.

а) б)
Рисунок 24. Изотермический разрез системы Fe-C-Cr при :а) 800 0С б) 1000 0С
В отличие от углерода, хром в стали повышает устойчивость при отпуске. Хром резко тормозит первую стадию, а именно распад мартенсита, твердость хромистого мартенсита сохраняется до температуры 450-500, примерно в этот же интервал сдвигается, и распад аустенита остаточного и если аустенит остаточный в закаленной стали осталось много, то при отпуске может произойти повышение твердости по сравнению с закаленном состоянием.
Хром повышая АС1 повышает и первую ступень, а вторую понижает, разделяя их резко. Обе ступени сдвигаются вправо при этом очень сильно вправо сдвигается вторая ступень.
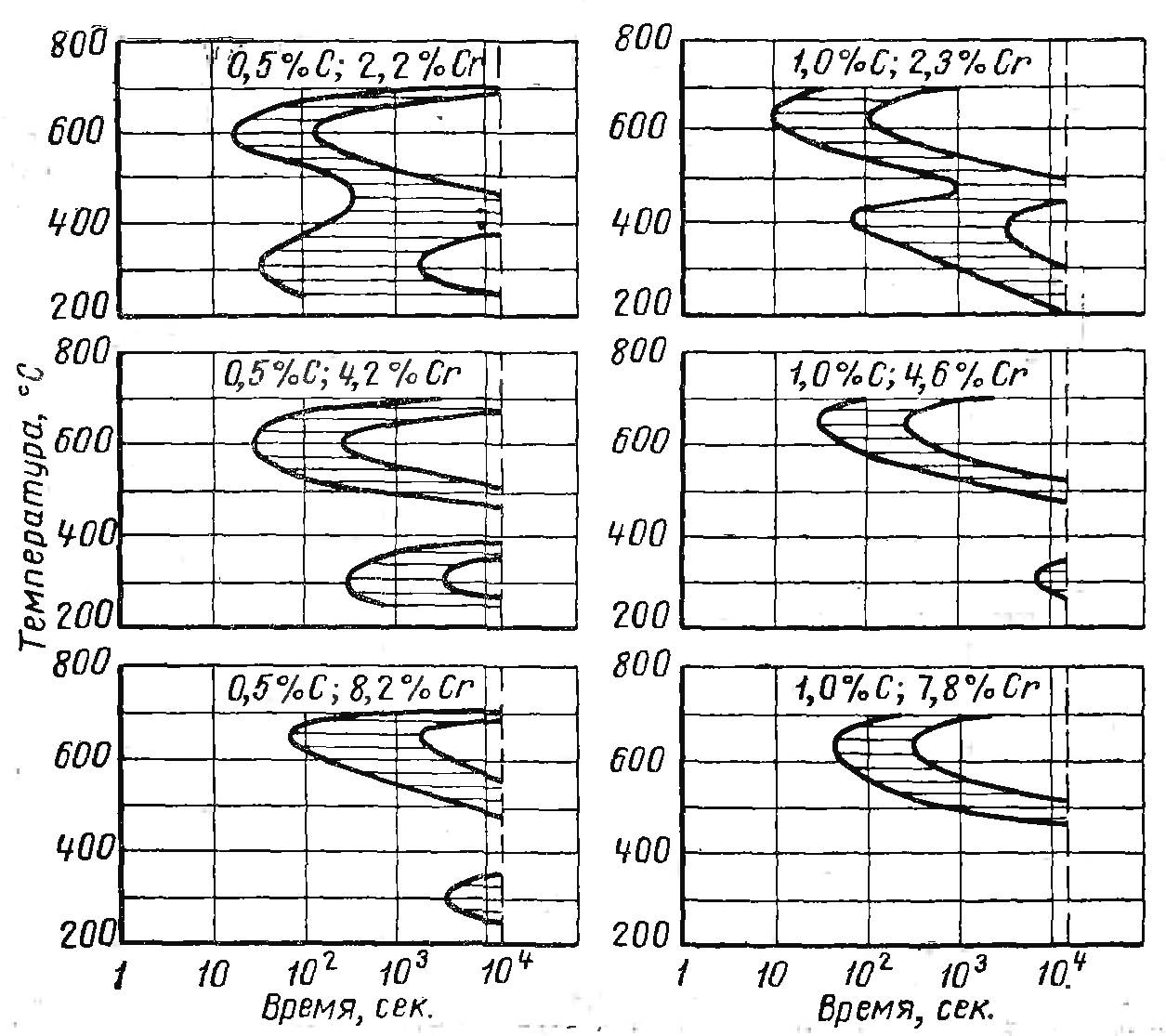
Рисунок 25. Влияние хрома на диаграммы кинетики изотермического превращения аустенита в сталях с содержанием углерода 0.5 и 1%.
Никель: кристаллизуется с образованием ГЦК решетки причем параметры ГЦК железа и ГЦК никеля близки: αFeγ=3.6394кХ, αNi=3.5165кХ. Никель не карбидообразующий элемент с железом он образует непрерывный ряд твердых растворов замещения, с расширением γ-области и сужением α-области. Никель повышает критическую точку А4, а понижает критические точки Ас1 и Ас3. В системе имеется интерметаллид FeNi3, представляющий собой упорядоченный твердый раствор. Диффузионные процессы в железо никелевых сплавах сильно затруднены, поэтому диаграмма не имеет точных линий при низкой температуре. Если сплавы охлаждаются с реальными скоростями, то превращении протекает бездиффузионным путем и с большим гестерезисом (отставанием).
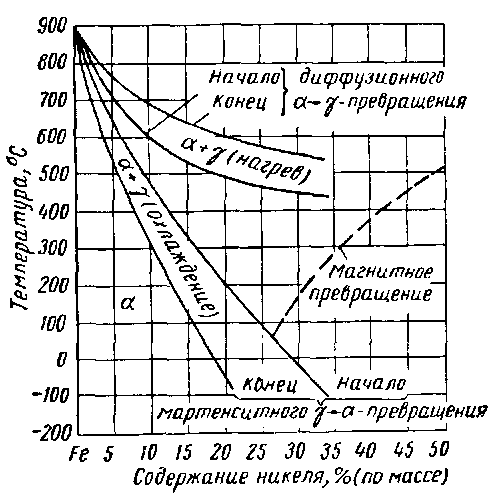
Рисунок 26. Реальная диаграмма железоникелевых сплавов.
Все эти превращения не равновесны, если взять сплав порядка 30% Ni, то он окажется чисто аустенитным. Равновесные диффузионные процессы в железоникелевых сплавах протекает при содержании Ni не более 4-5%. Если Ni больше 6% то для достижения равновесия нужно охлаждение длительностью до 2 лет.
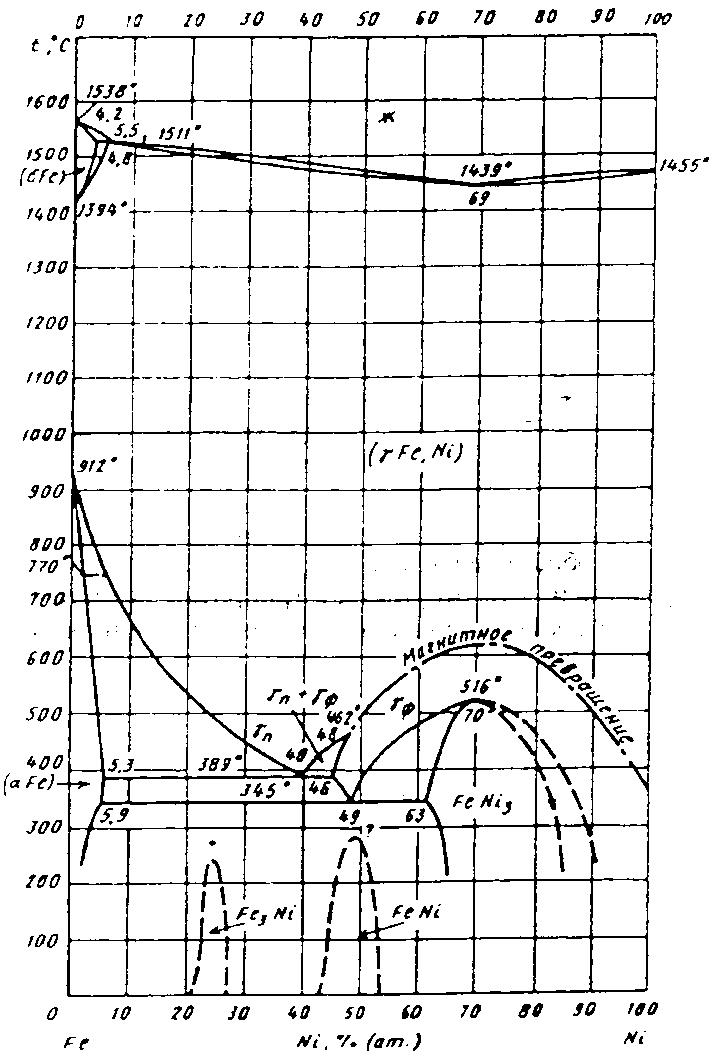
Рисунок27.. Диаграмма состояния системы железо – никель.
Вследствие крайне медленной диффузии диаграмма Fe-Ni-C не может быть построена опытным путем, часть диаграммы построена расчетным путем. Никель попадая в карбид делает его неустойчивым, способствует распаду карбида, никель графитизатор.
Увеличение содержания никеля приводит к замедленному распаду аустенита, сдвигу с-кривых вправо, уменьшению критической скорости закалки, за счет чего растет прокаливаемость. За счет снижения эвтектоидного интервала первая ступень понижается и сильно сдвигается вправо. Никель понижает мартенситный интервал 1% никеля на 20 0С. На процессы распада при отпуске никель влияет слабо.

Рисунок 28.. Влияние никеля на диаграммы кинетики изотермического превращения аустенита в сталях с содержанием углерода 0.56 и 1%.
Марганец: по кристаллической природе является сложным элементом, имеющим до температуры плавления 4 модификации
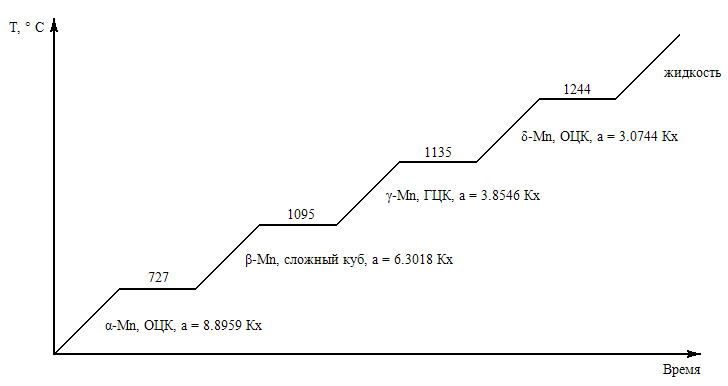
Рисунок 29. Модификации марганца
Марганец растворяясь в α и γ железе, расширяет γ-область, критические точки повышает Ас4 понижает Ас1 и Ас3. Диффузия марганца протекает очень медленно, поэтому диффузионные процессы в системе очень затруднены. При температуре ниже 400° С кривые для точек Ас1 и Ас3 не удается нанести точно: не помогает выдержка в течении двух недель (не гарантирует устойчивости) и даже не помогает наклеп. При большом содержании марганца сплавы находятся в термодинамически устойчивом состоянии. Очень часто вместо равновесной диаграммы приводят кинетическую диаграмму.
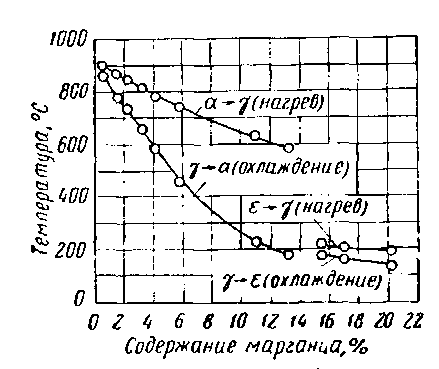
Рисунок 30. Кинетическая диаграмма состояния системы железо – марганец
При охлаждении с реальными скоростями γ и α превращения протекает бездиффузионным путем и при более низкой температуре, следовательно α-фаза будет мартенситом, но мягким, т.к. тут раствор замещения. При нагреве пойдет обратный процесс, но при более высокой температуре.
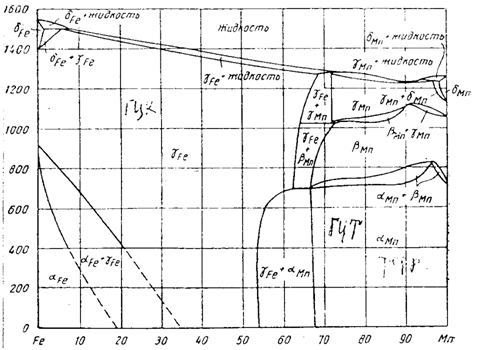
Рисунок 31. Диаграмма состояния системы железо – марганец
Марганец хоть и слабый но он карбидообразующий элемент. В тройной системе Fe-Mn-C (образуется сложный по составу карбид Fe,Mn)3C. С увелечением количества марганца эвтектоидный интервал понижается. При содержании Мп 12-14% сталь будет в аустенитном состоянии, марганец смещает точку S влево, т.е. уменьшает растворимость углерода в эвтектоиде. Марганцовистые стали в связи с пониженными критическими точками опасны возможностью перегрева.
Влияние марганца на процессы при отпуске незначительные. В марганцовистых сталях после закалки остается повышенное количество остаточного аустенита, т.к. марганец сильнее всех понижает мартенситный интервал. Кроме того диффузионные процессы в марганцовистой стали замедлены, в связи с этим процессыраспада мартенсита и аустенита немного сдвинуться в область повышенных температур, но принципиальных различий не наблюдается.
Поскольку марганец сильно тормозит диффузию, то диффузионное превращение сильно сдвигается вправо.
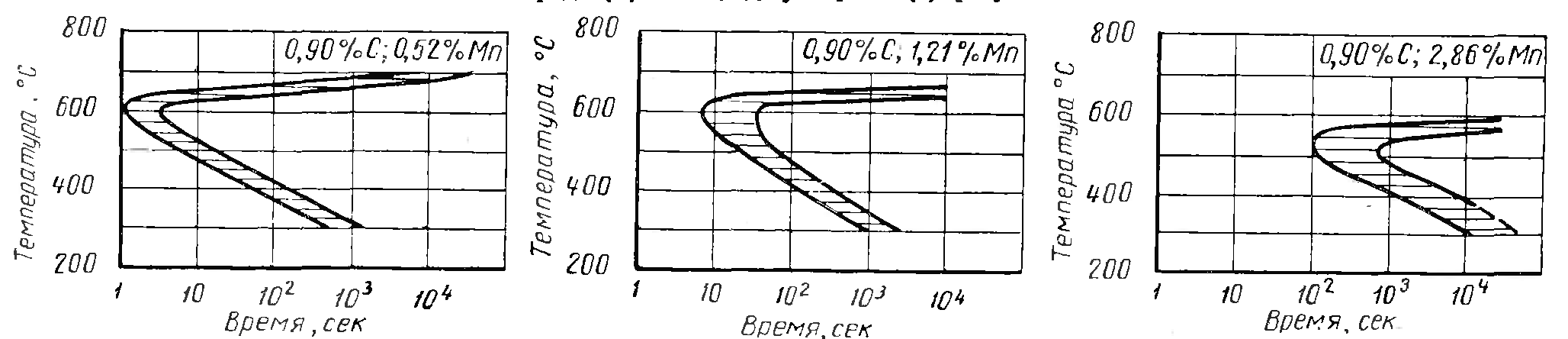
Рисунок 32. Влияние марганца на диаграмму изотермического превращения аустенита в углеродистой стали с содержанием 0.9% С.
Титан: существует в двух кристаллических модификациях: α-Ti с ГПУ решеткой (a = 2.951 Å; с = 4.697 Å) и β-Ti с ОЦК решеткой (a=3,269 Å). Титан относится к группе хрома: расширяют α-область и сужают γ-область. Повышает Ас1. В системе железо – титан образует три интерметаллида: TiFe2, TiFe, TiFe(?).
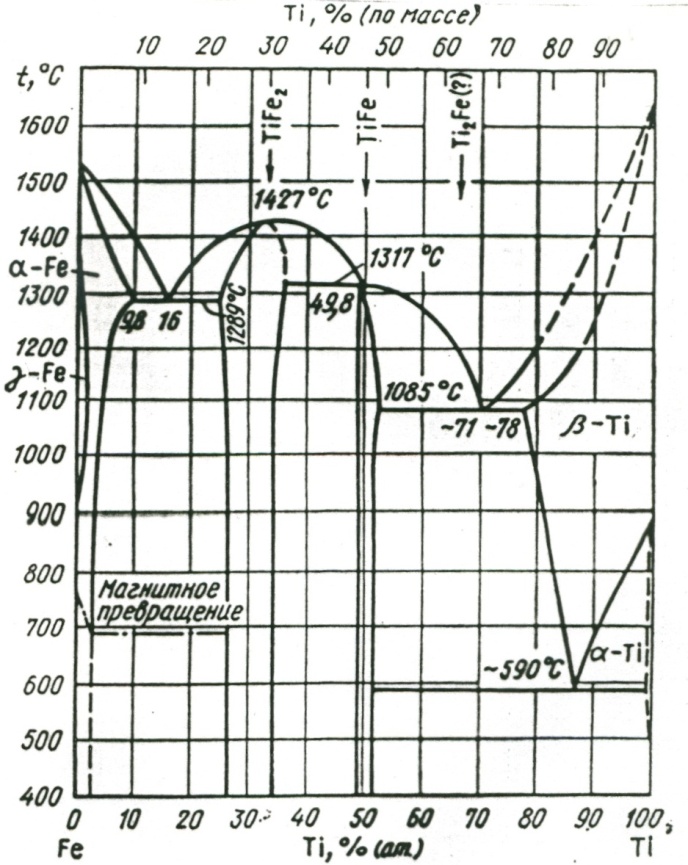
Рисунок 33. Диаграмма состояния системы железо – титан.
Ванадий: решетка ОЦК, параметр а=3,028кХ, ванадий принадлежит к числу элементов резко ограничивающих γ-область и расширяющий α-область. В системе имеется интерметаллид подобный σ-фазе в диаграмме Fe-Cr. Его состав можно определить формулой FeV. Это соединение может растворять избыточное количество и железа и ванадия с образованием двух фазных областей. FeV изоморфен, он имеет тетрагональную решетку с параметром а=8,95 кХ, с=4,62 кХ. Ванадиевая σ-фаза придает хрупкость если ее много в сплаве. Ванадий, подобно титану, резко повышает точку Ас1.
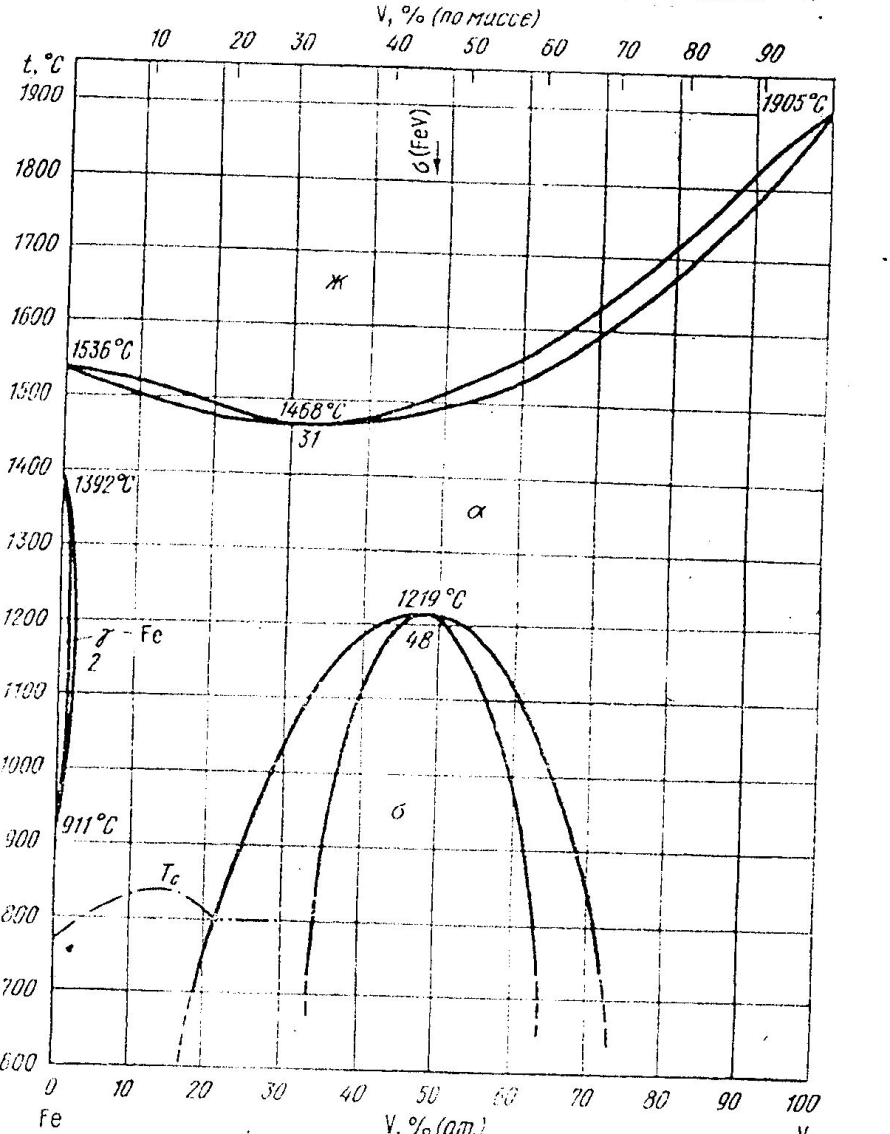
Рисунок 34. Диаграмма железо - ванадий
В тройной системе Fe-C-V не образуется собственного сложного карбида. Имеется только два карбида – цементит и спец карбид VC. Ванадий практически не растворим в цементите, и не влияет на его свойства. В свою очередь железо не присутствуют в спец карбиде МеС. Растворимость VC в аустените зависит от наличия других карбидов в сплаве. В сталях легированных только ванадием карбид начнет растворяться только при температуре порядка 1100-1150 0С насыщая твердый раствор до 1,5 %. Растворение карбидов будет сопровождаться ростом зерна. В сталях легированных другим корбидообразователями растворение МеС затруднено, он имеет более мелкие размеры, чем другие карбиды, и более равномерно распределен в структуре. Именно в этих двух особенностях карбида скрывается польза введения ванадия – т.е. дисперсность и способность сохранятся нерастворимым до высоких температур, что делает сталь особенно мелкозернистой, а следовательно вязкой.
Ванадий замедляет диффузионное превращение причем сильнее замедляет образование феррито-карбидной смеси. Несколько слабее образование феррита. В диффузионной области увеличивается бейнитное превращение сдвигаясь вниз и влево.
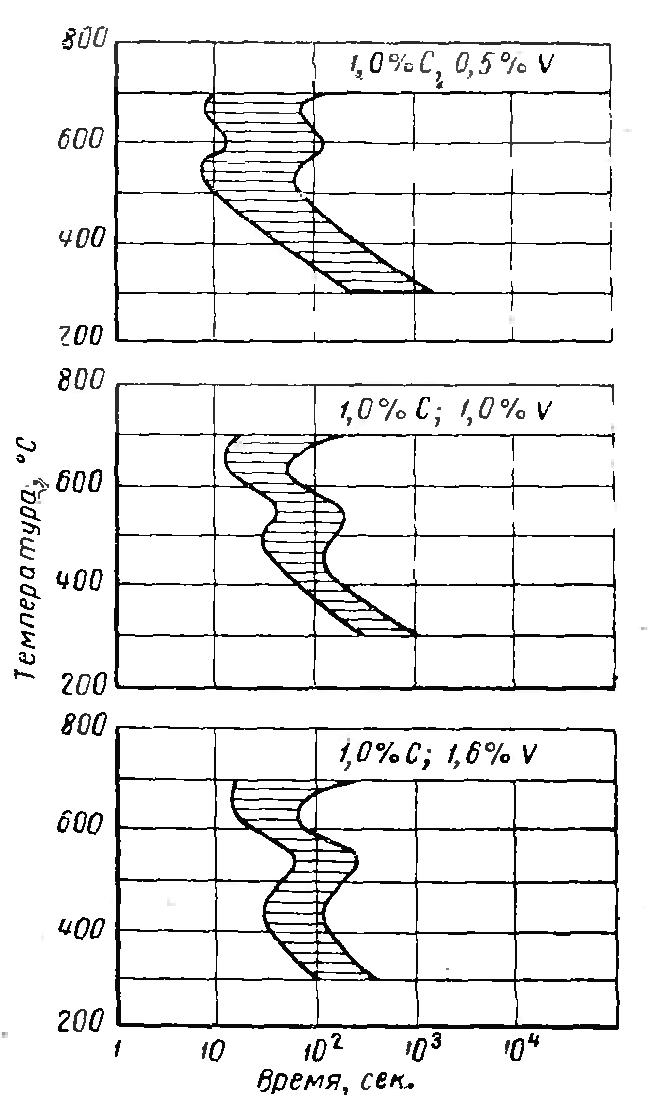
Рисунок 35. Влияние ванадия на диаграммы кинетики изотермического превращения аустенита в сталях с содержанием углерода 1%.
Высокая сила карбидообразования сказывается и на процессе распада мартенсита, распад сдвигается в область температур 650-6700С.
Молибден: полный аналог вольфрама и по свойствам и по по влиянием на процессы превращения. Молибден имеет ОЦК решетку с параметром а = 3.147 Å. Молибден расширяет α-область, и сужает γ-область. Он повышает критические точки Ас3 и Ас1. Сдвигает линию ES влево делая сплавы ледебуритными. Железо с молибденом образует две интерметаллические фазы: FeMo обладает структурой, аналогичной структуре σ-фазы в системе Fe – Cr, решетка тетрагональная, параметр а= 9.19 кХ, с= 4.81 кХ, с/а = 0.52 образуется при 63.2% Mo, стабильна только при высоких температурах область гомогенности этой фазы при 1180 – 1300° С не превышает 0.4%. Вторая интерметаллическая фаза – Fe7Mo6 имеет чрезвычайно узкую область гомогенности, решетка ромбоэдрическая, параметр а = 8.99 кХ, α=30º38´ образуется при 59.57% Mo. Не исключается образование интерметаллида Fe2Mo. Молибден является сильным карбидообразователем.
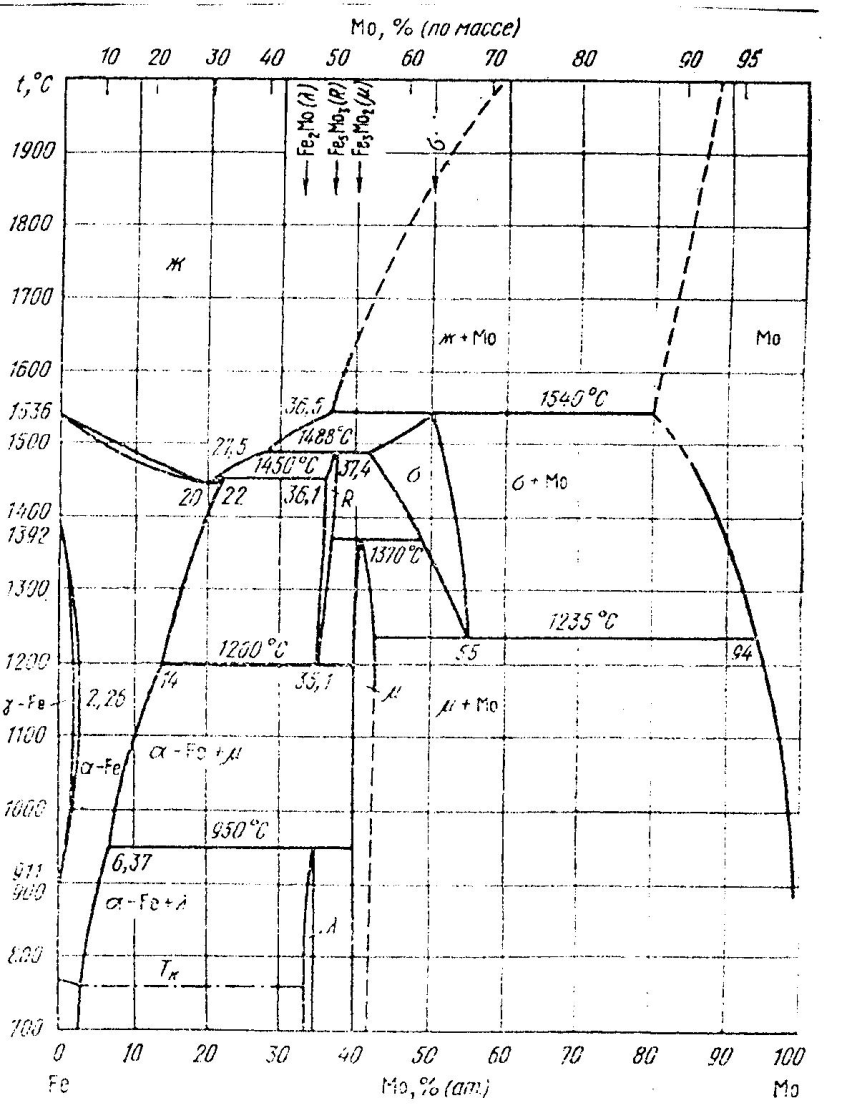
Рисунок 36. Диаграмма состояния системы железо – молибден
В тройной системе Fe-C-Mo имеется два сложных карбида – это Ме3С((Fe,Мо)3С), Ме6С(Fe3Мо3С). Эти карбиды удовлетворительно растворимы в аустените. Есть специальные карбиды МоС и Мо2С. Они труднее растворимы в аустените, зато более способны сдерживать рост зерна.
На устойчивость переохлажденного аустенита молибден влияет следующим образом – он разделяет две ступени по температурной шкале. Он сильно замедляет перлитное диффузионное превращение и слабо влияет на промежуточное превращение. Но так молибден влияет в доэвтектоидных сталях. Если взять сталь заэвтектоидную, то и вторая ступень сильно сдвинута вправо. Начало мартенситного превращения молибден понижает на 15-20 градусов.
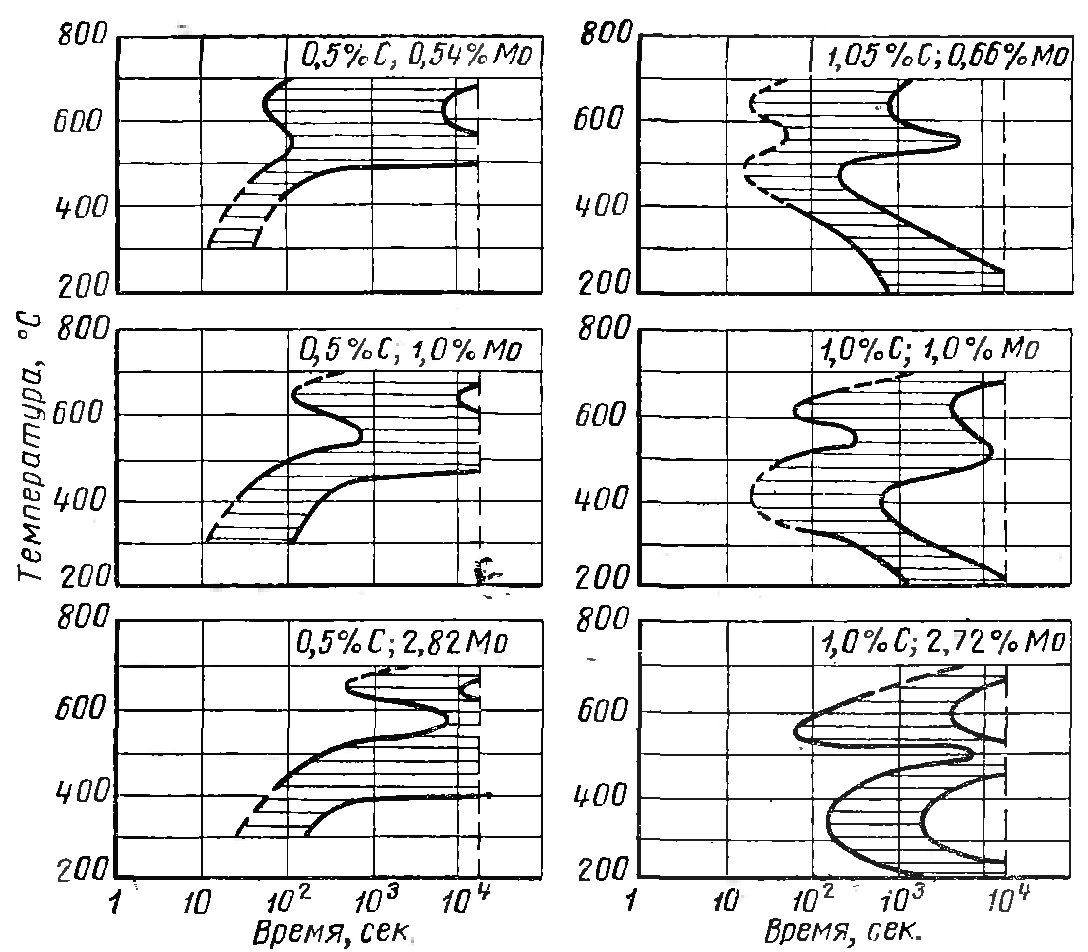
Рисунок 37. Влияние молибдена на диаграммы кинетики изотермического превращения аустенита в сталях с содержанием углерода 0.5 и 1%.
Рассмотрим влияние легирующих элементов на температуру начала мартенситного превращения и количество остаточного аустенита, оно показано на рисунке 19:

Рисунок 38. Влияние легирующих элементов на температуру мартенситного превращения (а) и на количество остаточного аустенита (б) в стали с 1% С.
Список литературы:
Гудремон Э. Специальные стали 1 и 2 тома 2-е изд. сокр. и перераб. М: Металлургия 1966.
Гуляев А.П. Металловедение. Учебник для вузов. 6-е изд., перераб. и доп. М.: Металлургия, 1986. 544 с.
Геллер Ю.А. Инструментальные стали. 5-е изд. М.: Металлургия, 1983. 527 с.
Геллер Ю.А. Материаловедение. 5-е изд., перераб. и доп. М.: Металлургия, 1983. 384 с.
Гольдштейн М.И. Специальные стали. Учебник для вузов. М.: Металлургия, 1985, 408 с.
Журавлев В.Н. Машиностроительные стали. Справочник. 3-е изд., перераб. и доп. М.: Металлургия, 1981. 391 с.
Шишков М.М. Марочник сталей и сплавов: Справочник. Изд. 3-е изд. Дополненное. Донецк: Юго-Восток, 2002, 456с.
Марочник машиностроительных сталей. ОМТРМ 0056-001-65. М. 1965. 592 с.
Сорокин В.Г., Волосникова А.В. Марочник сталей и сплавов. М.: Машиностроение. 1989. 640 с.
Химушин Ф.Ф. Жаропрочные стали и сплавы. 2-е изд. М.: Металлургия. 1969. 752 с.
Березовский Ю.Н. Детали машин. Учебник для машиностроительных техникумов. М.: Машиностроение, 1983, 384 с.
Солнцев Ю.П. Специальные материалы в машиностроении. Учебник для вузов. СПб.: ХИМИЗДАТ, 2004, 640 с.
Попов А.А., Попова Л.Е. Справочник термиста. Изотермические и термокинетические диаграммы распада переохлажденного аустенита. М. 1961. 430 с.
