Теория ковалентной связи
Для объяснения образования ковалентной связи применяют два приближенных метода расчета систем, состоящих из ядер и электронов:
- метод валентных связей (ВС),
- метод молекулярных орбиталей.
Рассмотрим метод валентных связей (локализованных электронных пар).
Теория Гейтлера – Лондона. Метод валентных связей (МВС).
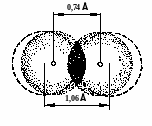
В 1927 году В.Гейтлер и Ф.Лондон произвели приближенный расчет молекулы водорода. Вначале они рассмотрели систему из двух атомов водорода, находящихся на большом расстоянии друг от друга и выразили зависимость волновой функции рассматриваемой системы от координат. Далее они предположили, что найденная зависимость сохраняется и при сближении атомов водорода. В результате они получили уравнения, позволяющие найти зависимость потенциальной энергии системы, состоящей из двух атомов водорода, от расстояния r между ядрами этих атомов. Оказалось, что при совпадающем направлении спинов сближение атомов приводит к непрерывному возрастанию энергии системы, т.е. связь не образуется. При противоположно направленных спинах сближение атомов до некоторого расстояния r0 приводит к снижению энергии системы. При r = r0 система обладает минимальной потенциальной энергией, т. е. находится в самом устойчивом состоянии – образуется связь. Дальнейшее сближение атомов приводит к возрастанию энергии. Таким образом, lcв соответствует длине связи, а выделяющаяся при этом энергия (Есв – энергии связи. Полученные расчетные значения оказались близки к экспериментально найденным величинам. Для молекулы водорода энергия связи составляет 430,9 кДж/моль, а длина связи 0,74Å, что совпадает с экспериментальными данными.
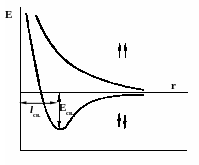
Рис 1.График изменения энергии системы, образующейся при сближении двух атомов водорода
Поскольку длина связи меньше суммы радиусов двух атомов водорода (0,53·2=1,06Å). Это позволяет сделать вывод, что при возникновении ковалентной связи происходит перекрывании электронных облаков с образованием молекулярного электронного облака, сопровождающееся уменьшением энергии.
Механизм образования связей. Согласно методу ВС химическую связь образуют два электрона с противоположными спинами (связь двухцентровая и двухэлектронная). Например, образование молекулы F2 по методу ВС представляется следующим образом:
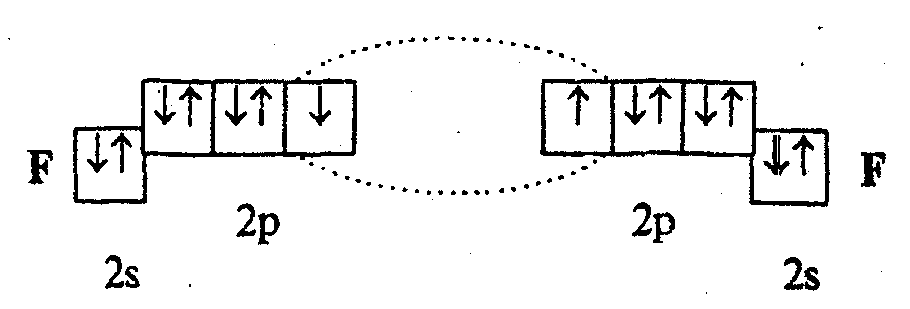
Каждая пара атомов в молекуле удерживается при помощи одной или нескольких электронных пар, образующихся за счет двух электронов, которые до образования связи принадлежали разным атомам. В случае образования нескольких электронных пар возникают кратные связи. Например, в молекуле азота осуществляется трехкратная связь NN, каждый атом приобретает устойчивую восьмиэлектронную оболочку.
Возможен и другой механизм образования ковалентной связи за счет неподеленных электронных пар одного атома А (донора) и свободных орбиталей другого В (акцептора):
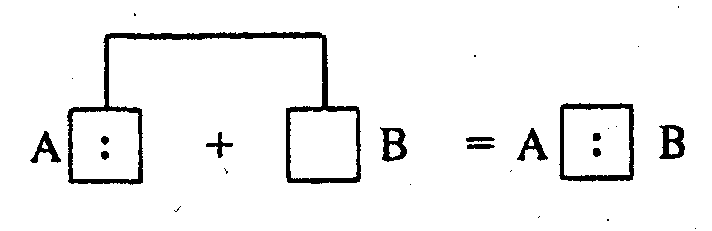
Такая связь называется донорно-акцепторной и отличается от обычной ковалентной связи только происхождением электронной пары.
Число общих электронных пар, связывающих атом данного элемента с другими атомами (число образуемых атомом ковалентных связей), называется ковалентностью элемента в данном соединении. Например, в молекулах СН4 и СО2 ковалентность углерода равна четырем, водорода – единице, а кислорода – двум.
Связь образуется путем перекрывания электронных облаков взаимодействующих атомов (длина связи меньше суммы радиусов взаимодействующих атомов). Чем в большей степени перекрываются
взаимодействующие электронные облака, тем прочнее ковалентная связь
Ковалентная связь насыщаема и направлена.
Насыщаемость связи - полное использование валентных возможностей атома. Количество связей, которое может образовать атом (его ковалентность), определяется количеством неспаренных электронов в основном и возбужденном состояниях атома. Ковалентность может быть повышена также за счет образования дополнительных донорно-акцепторных связей. Например, в молекуле СО количество связей равно трем: две связи образуются за счет объединения неспаренных р-электронов углерода и кислорода, а третья – за счет неподеленной электронной пары кислорода (донор) и свободной квантовой ячейки углерода (акцептор).
Валентные возможности атомов. Нормальное и возбужденное состояния.( см. главу «Периодический закон и периодическая система Д.И.Менделеева»)
Направленность связи. Поскольку перекрывающиеся облака определенным образом направлены в пространстве, возникающая химическая связь имеет направленный характер. Различают -, - и - связи.
- связи получаются в результате взаимного перекрывания орбиталей вдоль линии, соединяющей центры атомов.
-связи возникают при перекрывании орбиталей в направлении, перпендикулярном линии связи.
-связи возникают при перекрывании всех четырех лепестков d-орбиталей в параллельных плоскостях (рис. 2):
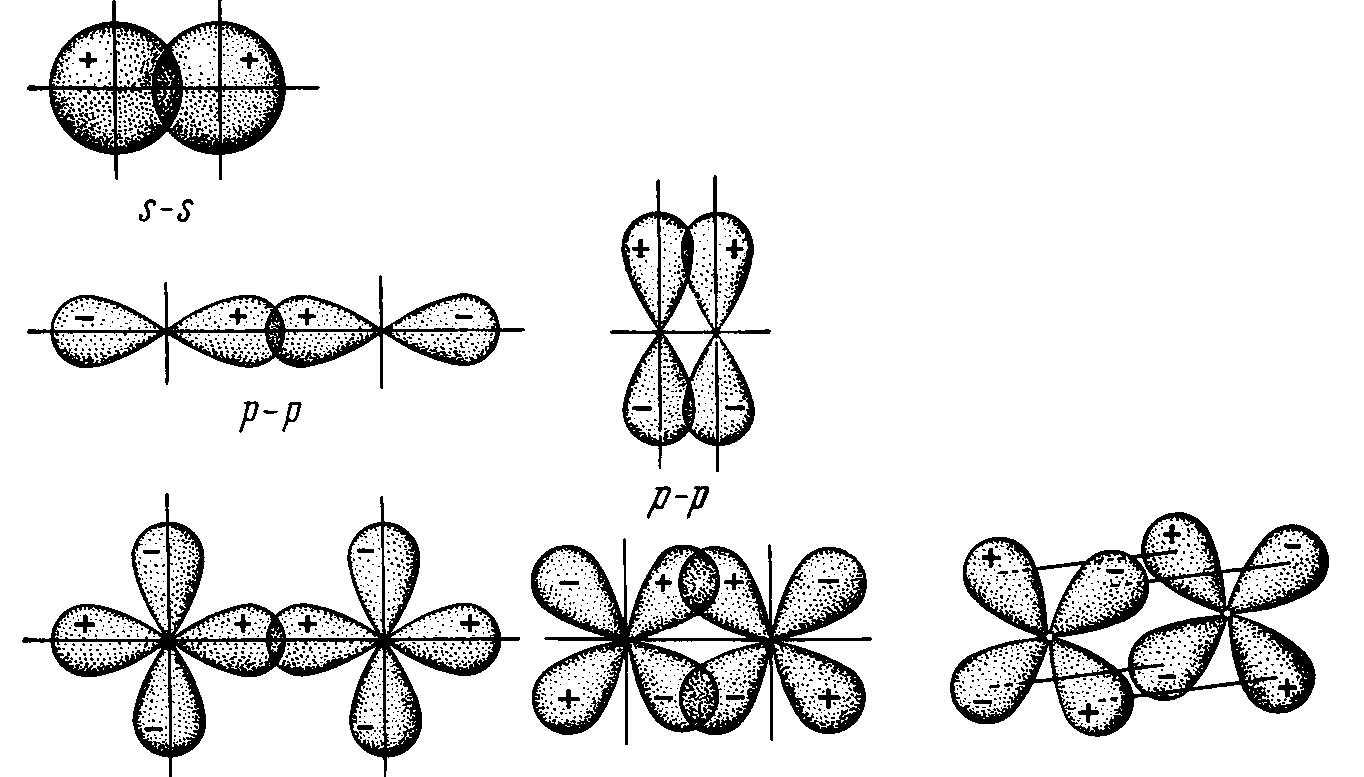
Рис. 2 Схема перекрывания орбиталей при образовании -, -, -связей
Таким образом, s-орбитали образуют только -связи; р-орбитали - и ‑связи; а d–орбитали – -, - и -связи. Эти связи различаются по энергии:
Е-связи> Е-связи> Е-связи
Итак, согласно методу ВС ковалентная химическая связь – двуцентровая, двухэлектронная, локализованная, направленная и насыщенная.
Геометрия и свойства молекул, образующихся из нормального состояния атомов
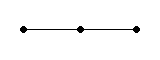
Молекулы типа А2: H2, O2, N2 линейные, неполярные. Кратность связи равна 1,2,3 соответственно.
Они образуются двумя одинаковыми атомами, между которыми могут возникать:
- одна одинарная σ- связь, за счет перекрывания двух s-(молекулы Н2) или двух р- орбталей (молекулы Cl2),
- двукратная связь – одна σ- и одна π- связи (молекулы О2),
- трехкратная - одна σ- и две π- связи (молекулы N2).
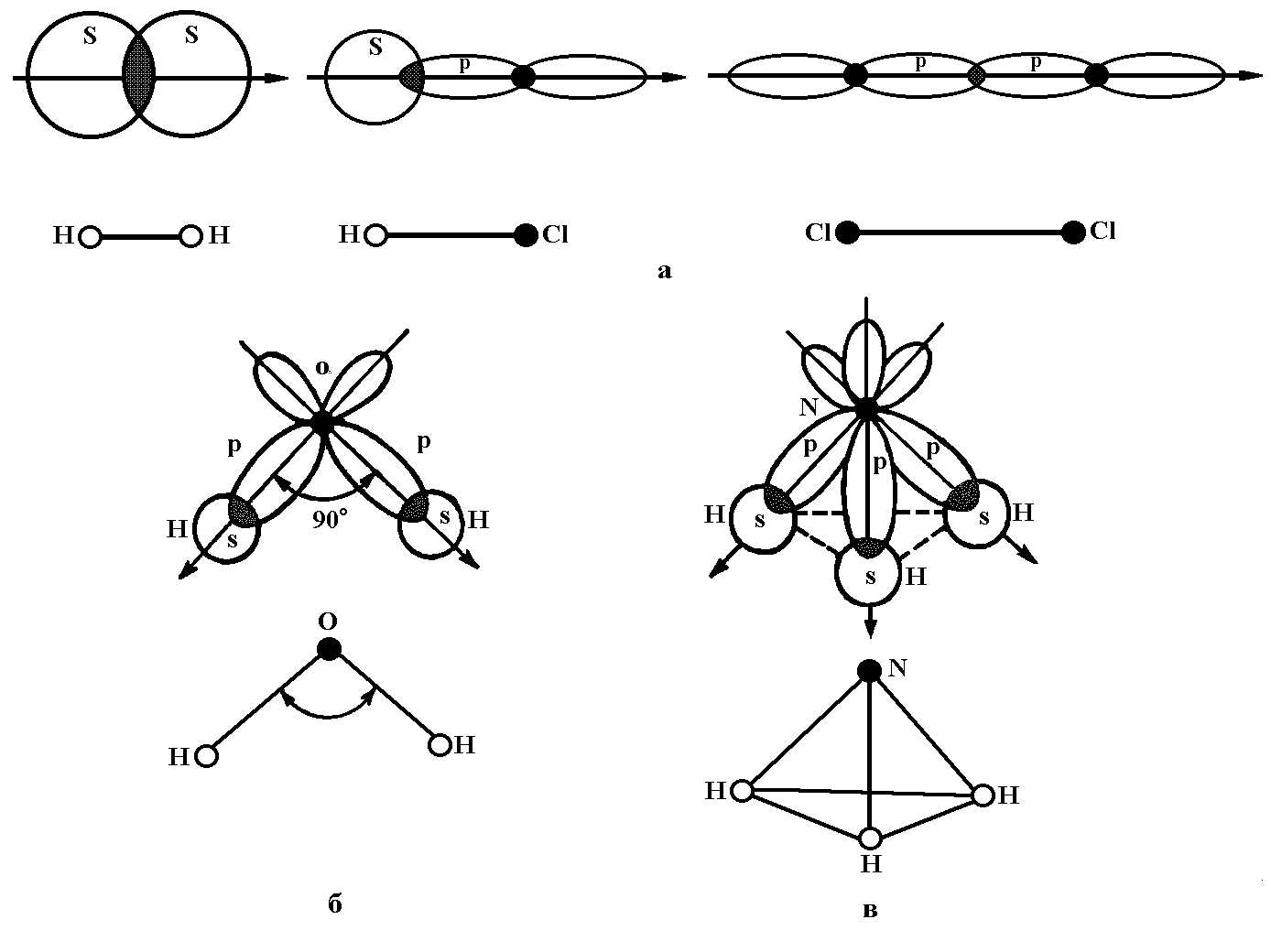
Рис.3 Формы молекул: а – линейная (А2, АВ); б – угловая (АВ2); в – пирамидальная (АВ3)
Молекулы типа АВ: HF, HCl, HBr, HI линейные, полярные.
Свойства связей в молекулах типа АВ
Свойство связи |
HF |
HCl |
HBr |
HI |
Длина, Å |
0,92 |
1,27 |
1,41 |
1,61 |
Энергия, кДж/моль |
565,7 |
431,6 |
364 |
298,3 |
Полярность, Д |
1,91 |
1,03 |
0,79 |
0,42 |
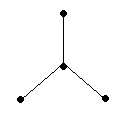
Молекулы типа А2В: H2O, H2S, H2Se, H2Te, H2Po угловые (α ≥ 90˚), полярные.
На рисунке 4 представлена схема образования молекулы Н2Те – два р-облака теллура перекрываются s – орбиталями двух атомов водорода:
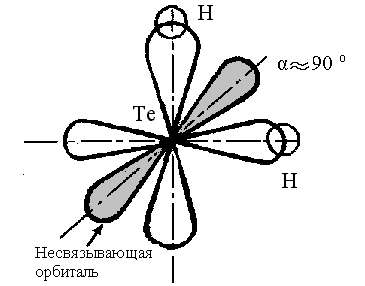
Рис.4 Схема образования связей в молекуле Н2Tе
В ряду : H2O, H2S, H2Se, H2Te, H2Po
Длина связи возрастает
Энергия связи уменьшается
Полярность связи уменьшается
Угол между связями уменьшается
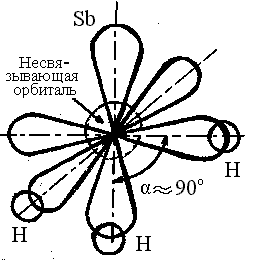
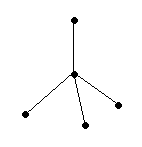
Молекулы типа АВ3: NH3, PH3, AsH3, SbH3 имеют форму тригональной пирамиды, (α ≥ 90˚), полярные.
На рисунке представлена схема образования молекулы SbH3 – три орбитали атома сурьмы перекрываются с тремя s – обиталями трех атомов водорода с образованием полярных σ – связей. Образующаяся молекула имеет пирамидальное строение с углом между связями ≈ 900 . Молекула полярна.
|
|
Cвойства связей в молекулах типа АВ3
Свойства связей |
NH3 |
PH3 |
AsH3 |
SbH3 |
Угол между связями, град |
107 |
94 |
92 |
91 |
Длина, Ả |
1,01 |
1,45 |
1,52 |
1,7 |
Энергия, кДж/моль |
380 |
323 |
281 |
256 |
Геометрия и свойства молекул, образующихся из возбужденного состояния атомов. Теория гибридизации.
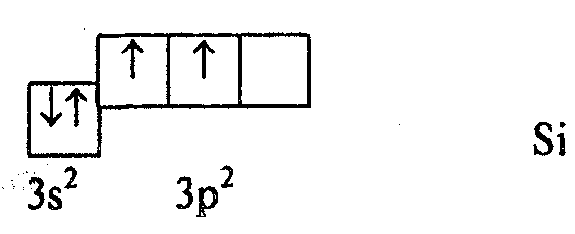
В рассмотренных примерах химическая связь образуется электронами одного энергетического подуровня (р). В большинстве же случаев в образовании химической связи участвуют электроны различных подуровней. Рассмотрим, например, молекулу SiCl4. Атом Si имеет в невозбужденном состоянии два валентных электрона и, следовательно, может образовывать только две связи.
Предположим теперь, что один из 3s-электронов в результате возбуждения перешел на 3р-подуровень, теперь атом Si может образовать четыре связи, причем выигрыш в энергии при образовании связей превосходит незначительную энергию возбуждения. Поскольку теперь у атома Si в образовании связи могут участвовать три р-электрона и один s‑электрон, логично предположить, что связи в молекуле SiCl4 должны быть неравноценными.
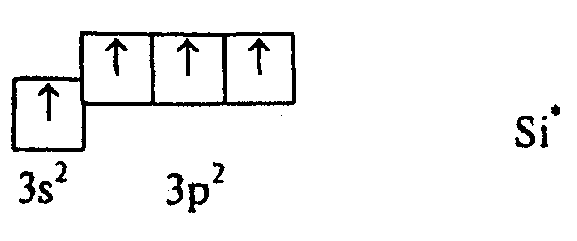
Однако исследования показывают, что связи в SiСl4 совершенно одинаковы (имеют одну и ту же энергию и длину) и направлены симметрично к вершинам тетраэдра. Этот факт можно истолковать как гибридизацию, т.е. смешивание валентных орбиталей различных подуровней, в результате чего возникают четыре новые (гибридные) орбитали, промежуточные по форме и энергии. В данном случае в гибридизации участвует одна s- и три р‑орбитали, поэтому имеет место sр3-гибридизация и форма образующейся молекулы тетраэдрическая.
Основные положения теории гибридизации:
(Л.Полинг и Дж.Слейтер, 1931г.).
1. При гибридизации, т.е. смешивании валентных орбиталей различных подуровней, возникают новые (гибридные) орбитали, промежуточные по форме и энергии.
2. Число образующихся гибридных орбиталей всегда равно числу смешивающихся орбиталей.
3. Связи, возникающие путем перекрывания гибридных орбиталей, совершенно одинаковы (имеют одну и ту же энергию и длину) и направлены симметрично. Исходя из этого, образующиеся при этом молекулы неполярны или малополярны.
4. Гибридные электронные облака асимметричны (рис.), поэтому они могут образовывать только σ-связи; перекрывание орбиталей происходит в большей степени и химические связи обладают большей прочностью, чем связи, образованные за счет негибридных электронных орбиталей.
5. При образовании кратных связей, π- связи образуются за счет негибридных орбиталей.
6. Геометрическую форму молекулы определяют σ-связи.
7. Тип гибридизации определяется типом и количеством смешивающихся орбиталей (sp-, sp2-, sp3-, dsp2-, dsp3-, sp3d2- ).
Рассмотрим образование химических связей в молекуле ВеF2:
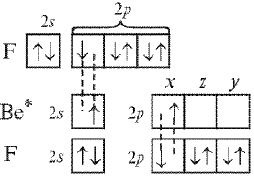
В образовании связей участвуют 2s- и 2рх-орбитали возбужденного атома бериллия (рис. 6, а), которые должны перекрываться с соответствующими 2р-орбиталями атомов фтора. Из характера перекрывания следует, что связь, образованная 2рх-орбиталью бериллия, должна быть более прочной, чем связь, образованная его 2s-орбиталью. Направление образования первой связи строго определенное – вдоль оси х. Перекрывание 2s-орбитали не имеет преимущества в каком-либо направлении, поэтому угол между связями в молекуле ВеF2 может быть переменным.
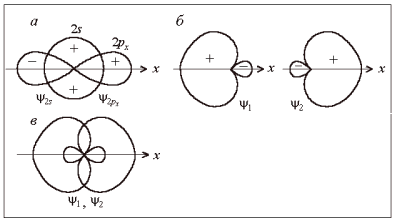
Рис. 6. Образование гибридных sp-орбиталей ψ1 и ψ2 (плюс и минус – знаки волновой функции)
Однако эти выводы противоречат экспериментальным данным, которые однозначно указывают, что угол между связями составляет 180° и они равноценны. Оказалось, что подобное несоответствие теории и эксперимента наблюдается там, где связи центрального атома образованы орбиталями разного типа симметрии (например, s и р; р и d; s, р и d).
Для объяснения такого несоответствия Л.Полинг и Дж.Слейтер разработали теорию гибридизации. Сущность ее состоит в том, что близкие по энергии валентные орбитали с различной симметрией преобразуются в такое же количество одинаковых гибридных орбиталей, каждая из которых представляет собой продукт смешения исходных орбиталей. Гибридные орбитали более вытянуты в направлении образования химической связи и обеспечивают лучшее перекрывание.
В нашем примере в гибридизации участвуют одна 2s- и одна 2р-орбиталь атома бериллия. Такой случай называется sp-гибридизацией. Гибридные орбитали представляют собой линейные комбинации исходных атомных орбиталей с учетом знаков их частей – «лопастей» (для 2s-функции общепринято выбирать знак плюс):
ψ1 = а1 ψs + b1 ψp (1)
ψ2 = а2 ψs + b2 ψp (2)
где a1, a2, b1, b2 – нормированные коэффициенты; в данном случае a1 = a2 = –b1 = b2 = 1/√2.
На рис. 6, б показана форма sp-гибридных орбиталей, графически построенных согласно формулам (1) и (2). При смешении волновых функций с одинаковыми знаками они складываются, а с противоположными – вычитаются. Поэтому гибридные волновые функции сильно деформированы вдоль оси симметрии и ориентированы вдоль нее. Линейное расположение (рис. 6, в) обеспечивает их минимальное отталкивание и минимальную энергию системы.
Отсюда становится понятным угол между связями (Be–F), равный 180°, и равноценность связей (рис. 7).
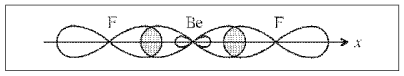
Рис. 7. Орбитали молекулы BeF2
Гибридные орбитали ψ1 и ψ2 по энергии занимают промежуточное положение между исходными атомными орбиталями (s и p) (рис. 8). Суммарная энергия электронов на гибридных орбиталях даже несколько больше, чем на исходных. Несмотря на то, что на гибридизацию затрачивается энергия, лучшее перекрывание гибридных орбиталей по сравнению с исходными атомными не только компенсирует энергетические затраты, но и обеспечивает энергетический выигрыш. В противном случае гибридизация не происходит.
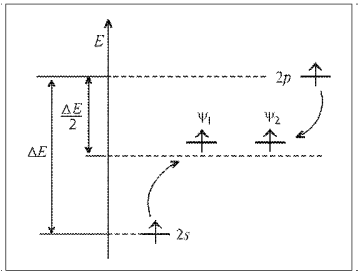
Рис. 8. Энергетическая диаграмма sp-гибридизации
sp-Гибридизация характерна для элементов II группы, но возможна и для атомов других элементов, образующих две s-связи с участием одной s- и одной р-орбиталей.
Участие в образовании связей одной s- и двух р-орбиталей центрального атома приводит к sp2-гибридизации. Гибридизация такого типа характерна для соединений элементов III группы.
Рассмотрим ее на примере молекулы ВF3. В возбужденном атоме бора при образовании связей происходит гибридизация трех орбиталей – 2s, 2рх, 2рz:
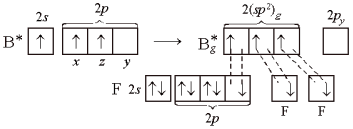
(Здесь у двух атомов фтора показаны только 2р-электроны, образующие связи.) Три гибридные орбитали (sp2)g в соответствии с принципом наименьшей энергии ориентируются так, чтобы отталкивание между ними было минимальным. Этому отвечают углы между осями гибридных орбиталей, равные 120° (рис. 9). Поэтому молекула ВF3 – плоская, связи в ней – равноценные, направленные по углам правильного треугольника.
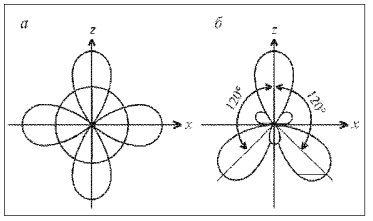
Рис. 9. sp2-Гибридизация: а – исходные 2s-, 2рx- и 2рz-орбитали; б – гибридные 2(sp2)g-орбитали
sp3-Гибридизация, в которой участвуют s-орбиталь и все три p-орбитали, характерна для соединений элементов IV группы периодической системы, в частности для насыщенных углеводородов. Рассмотрим молекулу метана СН4.
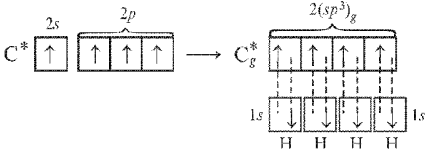
В этом случае (при sp3-гибридизации) образуются четыре sp3-гибридные орбитали, направленные в пространстве по углам тетраэдра. Углы между осями гибридных орбиталей составляют 109,46° (рис. 10). Рассмотренный ранее ион аммония NH4+ также имеет тетраэдрическое строение благодаря sp3-гибридизации.
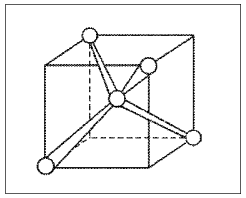
Рис. 10. Ориентация sp3-гибридных орбиталей в молекуле СН4
В гибридизации могут участвовать и d-орбитали внешнего или предвнешнего квантового уровня. При образовании комплексного иона [АlF6]3– происходит sp3d2-гибридизация, в которой участвуют вакантные d-орбитали:
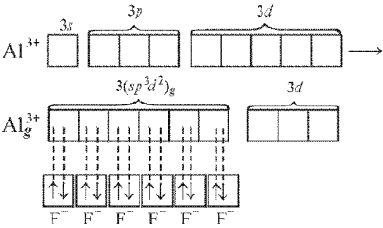
Такие шесть гибридных орбиталей направлены по углам октаэдра. Угол между связями 90° (рис. 11).
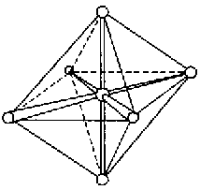
Рис. 11. Ориентация sp3d2- и d2sp3-гибридных орбиталей
В комплексном ионе [Fе(СN)6]4– в гибридизации участвуют «внутренние» d-орбитали предвнешнего квантового слоя. При возбуждении иона Fе2+, входящего в состав комплекса, происходит спаривание 3d-электронов и переход в гибридное валентное состояние:
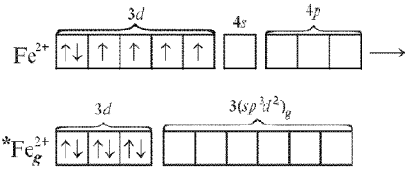
Связи образуются в результате взаимодействия вакантных гибридных d2sp3-орбиталей иона *Feg2+и неподеленных пар электронов шести ионов СN–. Тип гибридизации – d2sp3. Геометрическая форма комплекса также октаэдрическая.
Гибридизация с участием d-орбиталей дает и другие структуры молекул и сложных ионов.
Таким образом, направленность валентности обусловлена ориентацией гибридных орбиталей в пространстве. В обобщенной форме это представлено в табл. 1.
Таблица 1
Пространственная конфигурация молекул и ионов
Тип гибрдизации |
Валентные углы, форма молекулы |
Примеры |
sp |
180°
линейная
|
H–Be–H, HC≡CH |
sp2 |
120°
плоская тригональная |
H2C=CH2, C6H6, BCl3 |
sp3 |
109°28'
тетраэдрическая |
[NH4]+, CH4, CCl4, H3C–CH3 |
sp2d |
90°
квадратная |
[Ni(CN)4]2–, [PtCl4]2– |
sp3d или dsp3 |
90°, 120°
тригонально-бипирамидальная |
PCl5 |
d2sp3 или sp3d2 |
90°
октаэдрическая |
[Fe(CN)6]3–, [CoF6]3–, SF6 |
Гибридизация с участием орбиталей с неподеленными электронными парами.
Оказалось, что конфигурация не всех молекул может быть объяснена схемой, приведенной в табл. 2. Так, например, можно представить себе, что в молекуле аммиака NH3 три связи N–H образованы «чистыми» (т.е. негибридизованными) 2р-орбиталями азота.
Молекула должна иметь пирамидальную форму: в вершине пирамиды – атом азота, угол между связями – 90°. Однако экспериментально измеренный угол составляет ~107,8°, что значительно лучше согласуется с тетраэдрической конфигурацией, характерной для sp3‑гибридизации. Это можно объяснить, если предположить, что в гибридизации принимает участие орбиталь неподеленной (несвязывающей) пары электронов:
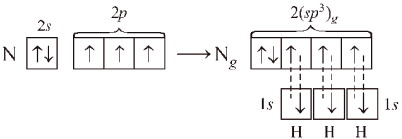
Перекрывание орбиталей в молекуле NH3 показано на рис. 12.
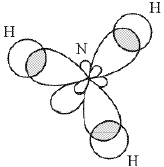
Рисунок 12. Перекрывание орбиталей в молекуле NH3
С этих же позиций участием орбиталей двух неподеленных пар электронов в sp3‑гибридизации можно объяснить строение молекулы воды, в которой угол между связями О–Н равен ~104,5°:
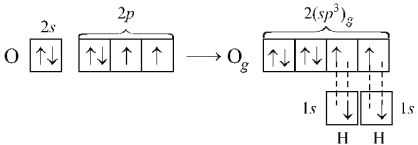
Вследствие более сильного отталкивающего действия неподеленных (несвязывающих) электронных пар валентные углы в молекулах NН3 и Н2О оказываются несколько меньше тетраэдрического.
Таблица 2
Изменение угла между связями Э–Н
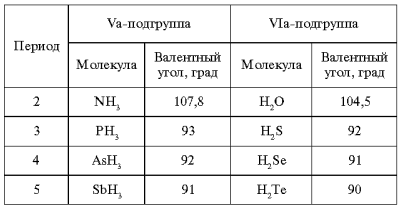
Для третьего и последующих периодов из-за увеличения размеров атомов и уменьшения плотности электронных облаков гибридизация, как реальное явление не наблюдается, связи образуются р-орбиталями. Это иллюстрирует табл. 2
В случае sp, sp2, sp3, sp3d2 гибридизации вершины в многограннике, описывающем геометрию химической частицы, равноценны, и поэтому кратные связи и неподеленные пары электронов могут занимать любые из них. Однако, sp3d-гибридизации отвечает тригональная бипирамида, в которой валентные углы для атомов, расположенных в основании пирамиды (экваториальной плоскости), равны 120o, а валентные углы с участием атомов, расположенных в вершинах бипирамиды, равны 90o. Эксперимент показывает, что неподеленные электронные пары всегда располагаются в экваториальной плоскости тригональной бипирамиды. На этом основании делается вывод, что они требуют больше свободного пространства, чем пары электронов, участвующие в образовании связи. Примером частицы с таким расположением неподеленной электронной пары является тетрафторид серы. Если центральный атом одновременно имеет неподеленные пары электронов и образует кратные связи (например, в молекуле XeOF2), то в случае sp3d-гибридизации именно они располагаются в экваториальной плоскости тригональной бипирамиды.
Механизм образования связи - обменный или донорно-акцепторный - не влияет на тип гибридизации электронных облаков атомов-партнеров. Линейная молекула ВеСl2 может образоваться в газовой фазе как из атомов Ве и Сl, так и из ионов Ве2+ и Сl-. В последнем случае ион Ве2+ (акцептор) предоставляет вакантные 2s- и 2p-орбитали, а ионы Сl- (доноры) - неподеленные электронные облака связи. Оба механизма в конечном итоге приводят к одному и тому же sр-гибридному состоянию.
В образовании молекулы CH4 и NH4+ принимают участие электроны 2s- и 2p-орбиталей. Общее число валентных электронов одинаково в обеих частицах. Именно вследствие sp3-гибридизации для них характерна одна и та же структура - правильного тетраэдра, несмотря на различие в механизме их образования.
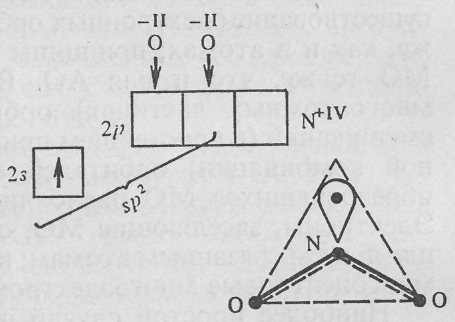
Наличие π-связей также не влияет на тип гибридизации. Однако наличие дополнительного связывания может привести к изменению валентных углов, поскольку электроны кратных связей сильнее отталкиваются друг от друга. По этой причине, например, валентный угол в молекуле NO2 (sp2-гибридизация) увеличивается от 120o до 134o.
Гибридизация в молекулах с кратными связями (частичная гибридизация).
При образовании кратных связей наряду с σ- образуются π-связи. В связи с этим можно предположить частичную гибридизацию, при которой часть электронов не участвует в гибридизации, оставаясь на р-орбиталях, и именно они являются ответственными за образование π-связей. Так, молекулах ацетилена С2Н2 и диоксида углерода СО2 каждый атом углерода образует две π- и две σ- связи, что позволяет предположить sp –гибридизацию. В молекулах этилена С2Н4 и бензола С6Н6 каждый атом углерода образует одну π- и три σ- связи. Учитывая вышесказанное, можно предположить, что в этих случаях имеет место sp2 –гибридизация. Такие предположения подтверждены экспериментально – валентные углы в этих молекулах соответственно 180 и 1200 .
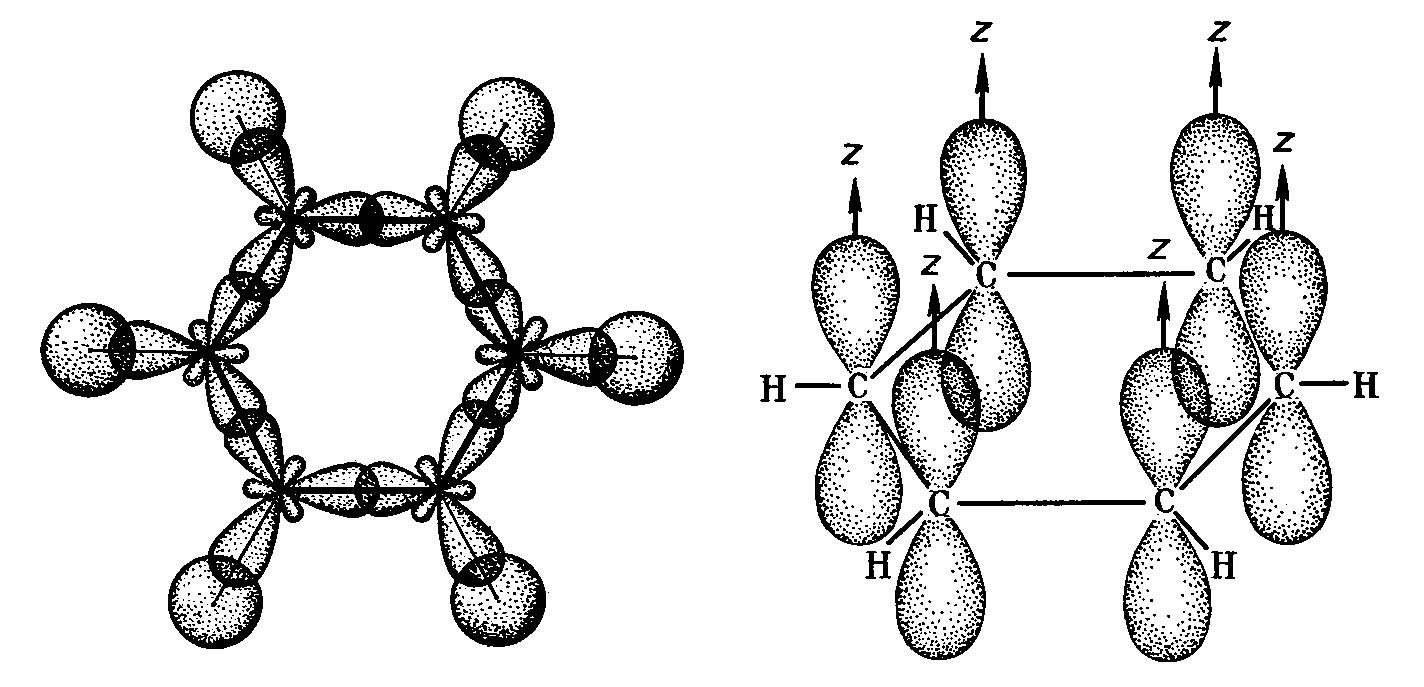
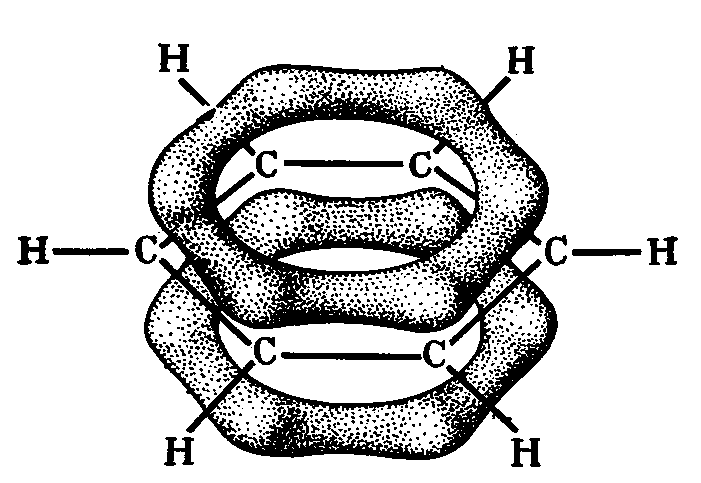
Рис.13 -Связи в молекуле бензола -Связи в молекуле бензола
Геометрическая форма молекул и реакционная способность веществ
Обычно вещества с симметричными молекулами химически более пассивны, чем вещества с асимметричными молекулами.
Так, реакционная способность диоксида серы SO2 (незавершенный треугольник) выше, чем у триоксида серы SO3 (правильный треугольник); сульфаты, содержащие симметричный анион SO42− (правильный тетраэдр), химически пассивны по сравнению с сульфитами, содержащими несимметричный ион SO32− (незавершенный тетраэдр).
В молекуле NO2 у атома азота N+IV (2s12p0) на одной из sp2-гибридных орбиталей находится не электронная пара, а неспаренный электрон. Такие молекулы особенно реакционноспособны, их называют радикалами.
В органической химии радикалами являются метил −CH3, этил −C2H5 и многие другие.
МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ (линейная комбинация атомных орбиталей) ММО ЛКАО
Метод Валентных Связей нагляден. Он позволяет теоретически предсказать форму и полярность молекул, валентные углы, виды и свойства реализуемых связей. Однако он не позволяет объяснить устойчивость частиц с нечетным количеством электронов, существование и образование частиц типа Н2+, Не2+ и т.д., не объясняет парамагнитные свойства некоторых молекул, например, кислорода. Эти трудности позволяет в некоторой степени преодолеть Метод Молекулярных Орбиталей.
Основные положения метода МО: 1) При образовании молекул все электроны переходят с атомных орбиталей (АО) на молекулярные орбитали (МО). 2) Количество МО равно сумме АО взаимодействующих атомов. Из двух АО образуется две МО, одна из которых обладает меньшей энергией и называется связывающей, другая – большей энергией и называется разрыхляющей.
Ψ+= С1 ΨА + С2 ΨВ
Ψ-= С3 ΨА – С4 ΨВ ,
где Ψ+ и Ψ- - волновые функции связывающей и разрыхляющей МО, С – доля участия соответствующих АО в формировании МО. На рисунках показаны схемы образования МО из АО различных типов:
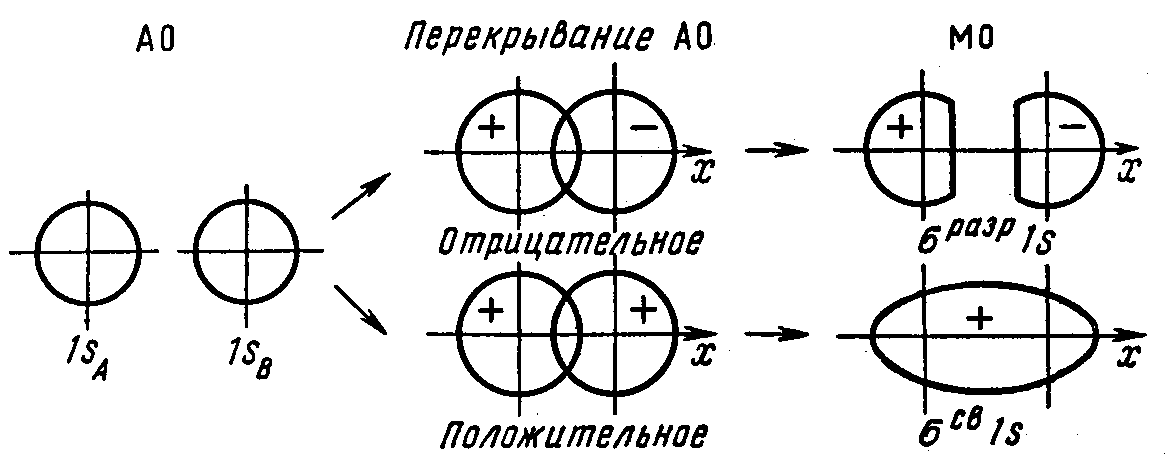
Рис. 14 Схема образования связывающей и разрыхляющей σs МО
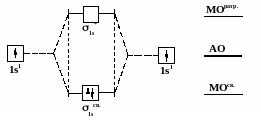
Рис. 15 Схема образования молекулы водорода из двух атомов по методу молекулярных орбиталей

Рис. 16 Схема образования связывающей и разрыхляющей σрх МО
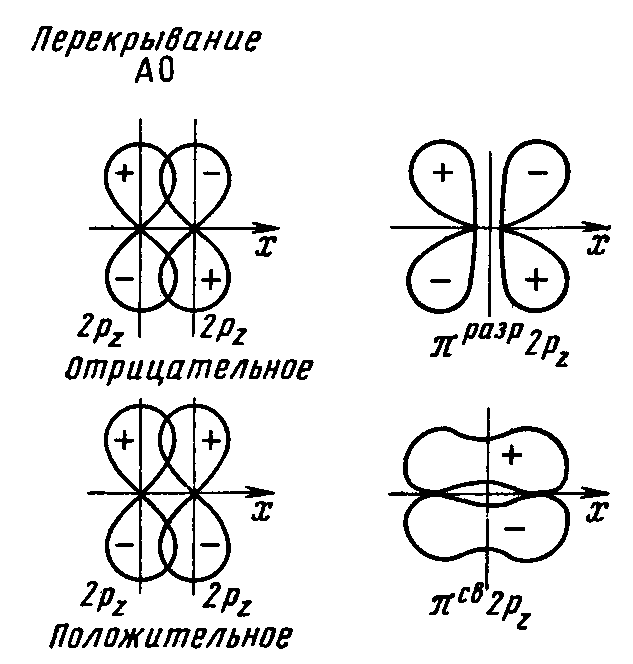
Рис. 17 Схема образования связывающей и разрыхляющей πру и πрz МО
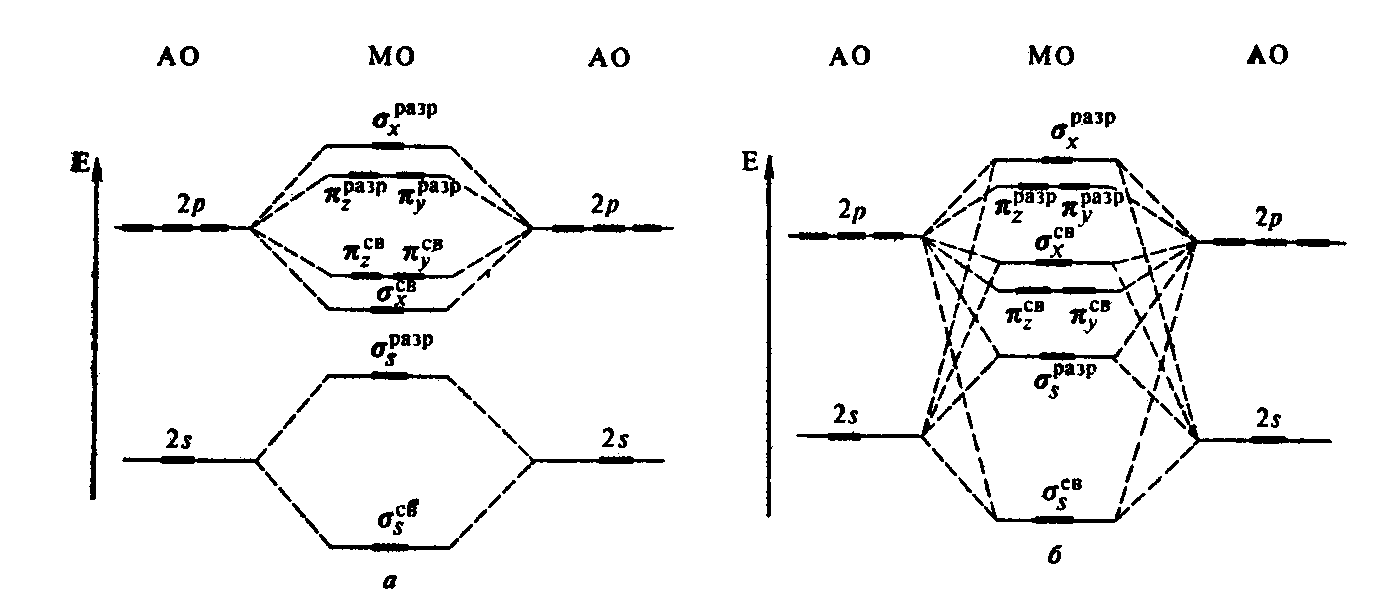
Схематично энергетическое распределение молекулярных орбиталей, образованных атомными орбиталями 2-го уровня, следующее:
А В
3) Заполнение МО происходит по принципу наименьшей энергии и правилу Хунда. Энергетический ряд МО:
А) при значительном энергетическом различии 2s и 2р орбиталей
σ1s св < σ1s разр < σ2s св < σ2s разр < σ2рх св <π2русв =π2рzсв< π2руразр =π2рzразр<σ2рх разр
В) при незначительном энергетическом различии 2s и 2р орбиталей
σ1s св < σ1s разр < σ2s св < σ2s разр <π2русв =π2р zсв < σ2рх св < π2руразр =π2рzразр<σ2рх разр
4) кратность связи равна полуразности количества связывающих и раэрыхляющих электронов. Образование молекул или заряженных частиц или радикалов возможно при условии, что число электронов на связывающих орбиталях больше, чем на разрыхляющих.
5) молекулы, имеющие неспаренные электроны, обладают парамагнитными свойствами.
Рассмотрим распределение электронов на МО молекулы кислорода:
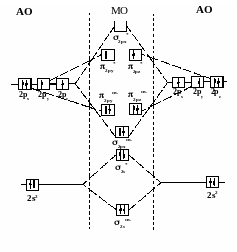
Электронный паспорт молекулы кислорода запишется так:
(σ1s св )2( σ1s разр)2( σ2s св)2( σ2s разр)2( σ2рх св)2(π2русв)2(π2рzсв)2(π2руразр)1 (π2рzразр)1(σ2рх разр)0
Кратность связи равна двум, имеется два неспаренных электрона, объясняющие парамагнитные свойства кислорода.
Электронный паспорт молекулы фтора:
(σ1s св )2( σ1s разр)2( σ2s св)2( σ2s разр)2( σ2рх св)2(π2русв)2(π2рzсв)2(π2руразр)2 (π2рzразр)2(σ2рх разр)0
Кратность связи равна единице, все электроны спарены, что объясняет диамагнитные свойства фтора.
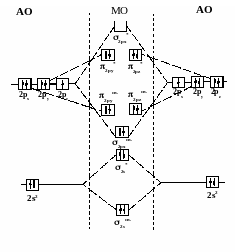
Распределение электронов на МО молекулы фтора.