Основы теории химической связи
Совокупность сил, удерживающих атомы в молекулах простых и сложных веществ, называется химической связью. Протекание химических реакций обусловлено разрывом старых и образованием новых связей. Согласно современным представлениям химическая связь образуется за счет перекрывания электронных облаков взаимодействующих атомов, при этом происходит перераспределение электронной плотности. В зависимости от характера распределения электронной плотности различают три основных типа химической связи: ковалентную, ионную и металлическую.
Общие свойства химической связи
Энергия связи Е, кДж/моль – энергия, которая выделяется при образовании химической связи, или которую нужно затратить для разрыва связи.
Например, энергии связей в молекулах водорода, кислорода и азота составляют:
H + H = H2 + 435кДж/моль
Есв(О2) = 493кДж/моль, Есв(N2) = 945кДж/моль
Длина lсв, Ả - расстояние между ядрами взаимодействующих атомов. Поскольку происходит перекрывание электронных облаков, то длина связи меньше суммы радиусов взаимодействующих атомов:
lA-B < rA + rB
Например
rH = 0,53Ả, lH-H = 0,74Ả
Полярность связи.
При образовании связи возможны три случая:
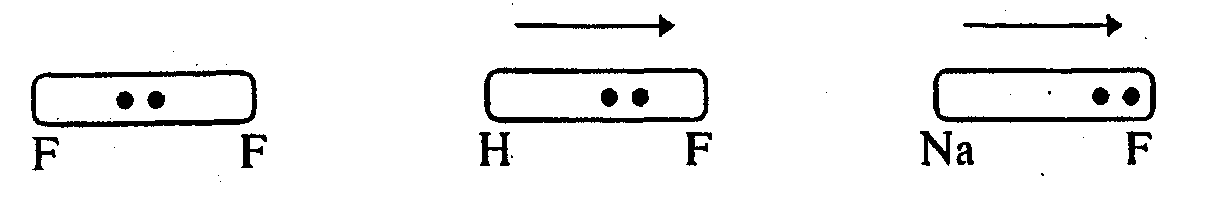
1) связь образуется двумя одинаковыми атомами (∆æ=0). В этом случае электронная плотность поровну распределена между связывающимися атомами. Возникает неполярная ковалентная связь;
2) связь образуется двумя атомами со слабо отличающимися электроотрицательностями (∆æ<1,5). Возникает полярная ковалентная связь (диполь);
3) связь образуют два атома с резко различающимися электро-отрицательностями (∆æ>1,5). Возникает ионная связь.
Примеры.
|
||
Ковалентная |
Ковалентная |
Ионная |
неполярная |
полярная |
связь |
связь |
связь |
|
Отметим, что деление связей на ковалентные неполярные, ковалентные полярные и ионные во многом условно, поскольку не существует резкой границы между этими типами связи. Можно говорить о ковалентной связи с некоторой долей ионности, о преобладании доли ионной связи и т.д.
Идеальная ковалентная связь существует лишь в частицах, состоящих из одинаковых атомов (Н2, N2 и т.д.). Если образуется связь между различными атомами, то электронная плотность смещается к одному из ядер атомов, то есть происходит поляризация связи. Смещение электронной плотности облака в направлении одного из партнеров по связи приводит к асимметрии центров положительных и отрицательных сил, расстояние между которыми l, называемое длиной диполя связи, служит мерой ее полярности. Длина диполя, а следовательно и полярность связи зависит от разности электроотрицательностей ∆æ взаимодействующих атомов lдип =f·(∆æ).
Полярность связи обычно выражают при помощи ее дипольного момента µ, представляющего собой произведение длины диполя lдип на величину заряда электрона q, выраженного в абсолютных электростатических единицах (q = 4,80 • 10-10 абс. эл.-ст. ед.). Так как длина диполя lдип имеет порядок атомных размеров, т. е. 10-8 см, то дипольный момент связи
µсв=lдип·q,
характеризуется величиной порядка 10-18 и размерностью абс. эл.-ст. ед. • см.
Для удобства пользования дипольными моментами величину 10-18 называют Дебаем и обозначают буквой D. Так, если длина диполя связи НСl равна l = 0,216 • 10-8 см, то дипольный момент ее равен:
µ = 0,216 • 10-8 • 4,80 • 10-10 = 1,04 • 10-8 эл.-ст. ед. • см = 1,04 D.
В системе СИ дипольный момент имеет размерность кулон-метр. Переход от одной размерности к другой может быть сделан исходя из следующих соображений: заряд электрона составляет
4,80 • 10-10 абс. эл.-ст. ед. = 1,6 • 10-19 Кл и, следовательно:
![]() ;
;
1 D = 1 • 10-10 абс. эл.-ст. ед. • 10-8 см = 0,33 • 10-19 • 10-10 = 0,33 • 10-29 Кл • м
В зависимости от полярности связи условно считаются: ковалентной полярной, если µсв <4Д и ионной, если µсв = 4 – 11Д .
Эффективный заряд атома. В результате перераспределения электронной плотности на атомах возникает некоторый заряд, который называют эффективным зарядом атомов в молекуле. В настоящее время неизвестны соединения, в которых эффективный заряд был бы больше двух. Для одного и того же атома, чем выше валентность, тем меньше эффективный заряд, т.е. больше доля ковалентной связи.
Ниже представлены эффективные заряды атомов в некоторых молекулах:
H+0,17Cl-0,17 Zn+0,86S-0,86 Na+0,8Cl-0,8
Эти молекулы полярны. Их можно рассматривать как системы, состоящие из двух равных по абсолютной величине, но противоположных по знаку зарядов, расположенных на определенном расстоянии друг от друга. Такие системы называются электрическими диполями.
Полярность (дипольный момент) молекул определяется не только полярностью связи, но и геометрией молекул.
Для многоатомных молекул он равен векторной сумме дипольных моментов отдельных связей. Например, молекула воды имеет угловую конфигурацию, сумма дипольных моментов связей не равна нулю и молекула полярна, а молекула диоксида углерода имеет симметричную линейную конфигурацию, сумма дипольных моментов связей равна нулю и молекула неполярна:

Для двухатомных молекул характер связи между атомами обусловливает и свойства самой молекулы. Так, при образовании ковалентно-неполярных связей в молекулах, например типа Х2, общее электронное облако симметрично, располагается между ядрами обоих атомов, центры тяжести положительных и отрицательных сил практически совпадают и дипольные моменты таких связей и молекул в целом равны нулю. Такие молекулы называются неполярными.
В двухатомных молекулах типа АВ, например НСl, СО, NО и т. п., связи имеют ковалентно-полярный характер и сами молекулы являются полярными. Для молекул подобного типа понятия полярности связи и молекулы являются однозначными и величины их дипольных моментов численно совпадают.
При переходе от двухатомных молекул к многоатомным типа АВ2, АВ3, АВ4 и т. д. соотношение между полярным характером связей А—В и молекулы в целом становится более сложным. Полярный или неполярный характер таких молекул является отражением их симметричной или несимметричной пространственной конфигурации.
Так, молекула АВ2 может иметь линейную структуру В—А—В или угловую. Молекула АВ3 может иметь структуру равностороннего треугольника, в центре которого находится А, а в углах - В, или структуру треугольной пирамиды, в вершине которой находится А.
Молекула АВ4 может иметь структуру квадрата или правильного тетраэдра с атомом А в центре.
В линейно построенных молекулах АВ2, треугольных АВ3, тетраэдрических и квадратно-плоскостных молекулах АВ4 дипольные моменты связей А—В взаимно компенсируют друг друга и результирующие дипольные моменты молекул равны нулю. Такие молекулы с полярными связями имеют в целом неполярный характер, что отражает, их симметричную пространственную структуру.
В несимметричных молекулах АВ2 и АВ3, имеющих, соответственно, угловую и пирамидальную структуру, взаимной компенсации не происходит. Для таких молекул характерно наличие разноименно заряженных участков, а расстояние l между центрами этих участков определяет величину дипольного момента молекулы.
Таким образом, определяя опытным путем дипольные моменты молекул, можно судить об их структуре.
Кратность связи определяется количеством электронных пар, участвующих в образовании связи. Например, в молекуле кислорода осуществляется двукратная связь О=О, а в молекуле азота - трехкратная NN. Чем больше кратность связи, тем она короче, и тем больше ее энергия. С другой стороны, поскольку σ- и π- связи энергетически неравноценны (Е σсв > Е π св ), то энергия двукратной связи меньше энергии двух однократных связей и энергия трехкратной связи меньше энергии трех однократных связей:
lC-C> lC=C> lCΞC , E C-C<EC=C <ECΞC , 2E C-C>EC=C , 3E C-C>ECΞC
В таблице приведены данные, свидетельствующие о соответствии кратности, длины и энергии связи для некоторых двухатомных молекул.
Свойство |
В2 |
С2 |
N2 |
O2 |
F2 |
Ne2 |
кратность |
1 |
2 |
3 |
2 |
1 |
0 |
Длина,Ả |
1,59 |
1,31 |
1,1 |
1,21 |
1,42 |
0 |
Энергия, кДж/моль |
288,4 |
627 |
940 |
494 |
159 |
0 |