Окислительно-восстановительные реакции
Реакции, протекающие с изменением степени окисления элементов, относятся к окислительно-восстановительным (О В Р ) реакциям.
BaCl2 + Na2SO4 = BaSO4↓ + 2 NaCl - реакция обмена
Sn+2Cl2 + Fe+3Cl3 → Fe+2Cl2 + Sn+4Cl4 - ОВР
Перепишем уравнение ОВР в ионном виде и подчеркнем ион-окислитель и восстановитель:
Sn2+ +2Cl‾ + Fe3+ + 3Cl‾ → Fe2+ + 2Cl‾ + Sn4+ + 4Cl‾ (1)
1│Sn2+ – 2ē = Sn4+ - процесс окисления Sn2+ - восстановитель
2│Fe3+ + ē = Fe2+ - процесс восстановления Fe3+ - окислитель
Окислитель – принимает электроны и при этом восстанавливается (процесс восстановления – процесс присоединения электронов),
восстановитель – отдает электроны и при этом окисляется (процесс окисления – процесс отдачи электронов).
В результате реакции окисления степень окисления восстановителя повышается, а степень окисления окислителя при восстановлении понижается.
В процессе окисления и восстановления должно участвовать одинаковое количество электронов. Поэтому нужно умножить первую строчку на один, а вторую - на два и сложить:
Sn2+ + 2Fe3+ = 2Fe2+ + Sn4+
Это окончательное уравнение реакции в ионном виде.
Степень окисления и валентность.
Под степенью окисления понимают условный заряд атома, который мог бы возникнуть, если бы все связи в молекуле были ионными. Степень окисления вычисляют исходя из электронейтральности молекул и учитывая, что водород в большинстве соединений (за исключением соединений с металлами) имеет степень окисления +1, кислород –2 (за исключением соединения с фтором, и пероксидных соединений), щелочные металлы +1, щелочнозенельные +2, степень окисления в простых веществах равна 0. Например:
Na2S+4O3, Na2S+6O4, KMn+7O4, K2Cr+62O7, K2Mn+6O4, Cl02
Степень окисления и валентность могут не совпадать. Наиболее характерно это для органических соединений:
C-4H4 C–2H3OH HC0HO C+4O2 HC+2OOH,
н о
из структурных формул видно, что углерод
во всех этих соединениях четырехвалентен
о
из структурных формул видно, что углерод
во всех этих соединениях четырехвалентен
Восстановители. Мерой восстановительной способности является величина ионизационного потенциала.
Восстановителями могут быть:
а) металлы: Ме - nē = Меn+, например Cu - ē = Cu+; Pb - 2ē = Pb2+.
б) отрицательно заряженные ионы неметаллов: 2I‾ - 2ē = I2
S2‾, Se2‾, Te2‾, I‾, Br‾, Cl‾
4) сложные ионы или молекулы, содержащие атомы в промежуточной степени окисления.
Например, Fe2+ - ē = Fe3+ Pb2+ -2ē = Pb4+ Sn2+ - 2ē =Sn4+
SO32‾, CrO2‾, AsO33‾, NO2‾ - ионы,
SO2, NO, MnO2 - молекулы.
Окислители. Мерой окислительной способности являются величины сродства к электрону и электроотрицательности.
Окислителями могут быть:
1) нейтральные атомы неметаллов(на внешнем уровне 4,5,6,7ē ):
Cl2 + 2ē =2Cl‾, S + 2ē = S2‾. Самым сильным окислителем является фтор F2
2) Ионы и молекулы, содержащие атомы металлов и неметаллов в высшей и промежуточной степенях окисления:
Pb4+, Sn4+, Cr3+, Fe3+, (ионы благородных металлов Ag+, Au+ )
CrO42‾, Cr2O72‾, MnO4‾, NO3‾, SO42‾, SeO42‾, ClO4‾.
Факторы, влияющие на протекание ОВР:
- природа взаимодействующих веществ;
- температура;
- катализаторы;
- концентрация:
- рН среды.
Влияние рН среды на протекание ОВР. Предполагается, что при протекании ОВР между кислородсодержащими молекулами или ионами происходит перераспределение атомов кислорода при участии различных частиц среды: в кислой среде - это Н+ и Н2О, в щелочной ОН– и Н2О, в нейтральной - Н2О (табл.1).
Участие частиц среды в переносе кислорода в ОВР.
рН среды |
Акцептор кислорода |
Донор кислорода |
Схема процесса |
||
рН < 7 |
Н+ |
Н2О |
2Н+ |
|
Н2О |
рН > 7 |
Н2О |
ОН– |
2ОН– |
|
Н2О |
рН = 7 |
Н2О |
Н2О |
Н2О |
|
2ОН– |
Н2О |
|
2Н+ |
|||
Составление уравнений ОВР методом ионно- электронного баланса.
При составлении уравнений ОВР следует придерживаться определенной последовательности.
Рассмотрим пример реакции, протекающей в кислой среде.
Даны исходные вещества:
KMnO4 + Na2SO3 + H2SO4
1. Определяем степени окисления элементов, находим окислитель, восстановитель и рН среды:
KMn+7O4 – окислитель (Mn находится в высшей степени окисления +7),
Na2S+4O3 – восстановитель (S находится в промежуточной степени окисления, равной +4),
H2SO4 – среда кислая (рН<7).
2. Записываем левую часть уравнения в виде ионов, учитывая только ионы, содержащие окислитель и восстановитель, а также ионы, обеспечивающие реакцию среды:
MnO4– + SO32– + H+
3. Записываем схему возможных полуреакций для процессов окисления и восстановления:
MnO4– Mn2+ |
(процесс восстановления) |
SO32– SO42– |
(процесс окисления) |
Составляем полуреакции:
а) вначале уравниваем число атомов элементов левой и правой частей полуреакций, используя частицы среды:
MnO4– + 8H+ Mn2+ + 4H2O
SO32– + H2O SO42– + 2H+
б) затем уравниваем заряды левой и правой частей полуреакций, используя переходы электронов:
MnO4– + 8H+ + 5ē = Mn2+ + 4H2O
SO32– + H2O – 2ē = SO42– + 2H+
в) находим коэффициенты:
2 |
MnO4– + 8H+ + 5ē = Mn2+ + 4H2O |
5 |
SO32– + H2O – 2ē = SO42– + 2H+ |
4. Суммируем две полуреакции с учетом коэффициентов и получаем сокращенное ионное уравнение:
2MnO4– + 16H+ + 5SO32– + 5H2O = 2Mn2+ + 8H2O + 5SO42– + 10H+
Сокращаем подобные члены:
2MnO4– + 6H+ + 5SO32– = 2Mn2+ + 3H2O + 5SO42–
5. Дописываем ионы, не принимающие участие в окислительно–восстановительном процессе, с учетом компенсации заряда. Количество и вид ионов, добавленных к левой и правой частям уравнения, должно быть одинаково.
![]() 2К+
SO42–
2К+
SO42–
6. Объединяем ионы в молекулы и составляем молекулярное уравнение реакции:
2KMnO4 + 3H2SO4 + 5Na2SO3 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
В качестве примеров рассмотрим уравнения еще двух реакций, протекающих в нейтральной и щелочной средах.
Реакция взаимодействия манганата калия с водой (нейтральная среда):
K2MnO4 + H2O KMnO4 + MnO2 + KOH
Ион MnO42–, содержащий Мn+6 в промежуточной степени окисления, может выполнять как функцию окислителя, так и функцию восстановителя.
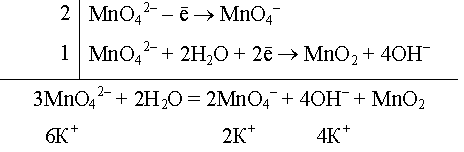
Запишем молекулярное уравнение реакции:
3K2MnO4 + 2H2O = 2KMnO4 + MnO2 + 4KOH
Уравнение реакции взаимодействия кремния с пероксидом водорода в щелочной среде:
Si + H2O2 + KOH K2SiO3 + H2O
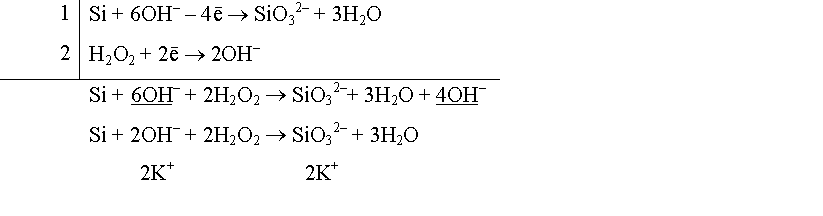
Si + 2KOH + 2H2O2 = K2SiO3 + 3H2O
Примеры влияния среды на продукты восстановления перманганата калия KMnO4 в кислой, нейтральной и щелочной средах:
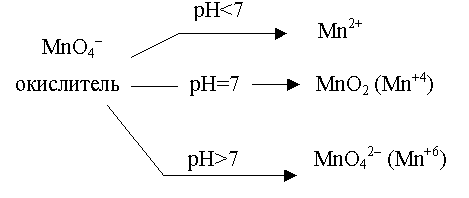
а) кислая среда (H2SO4 )
2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + K2SO4 + 3H2O+5 Na2SO4
роз.-фиол. кислая бесцв 2│MnO4‾ + 8H+ +5ē =Mn2+ + 4H2O
5│ SO32– + H2O –2ē = SO42– + 2H+
2MnO4‾ +16H+ +5 SO32– + 5H2O = 2Mn2+ + 8H2O + 5SO42– + 10H+
2K+ 3SO42– 10Na+ ------ = 2SO42– ------ 10Na+ 2K+ SO42–
б) нейтральная среда (H2O)
KMnO4 + Na2SO3 + H2O = MnO2 ↓+ Na2SO4 + KOH
роз.-фиол. нейтр. бурый
2│MnO4‾ + 2HOH + 3ē = MnO2 + 4OH–
3│SO32– + H2O –2ē = SO42– + 2H+
2MnO4‾ + 4H2O +3SO32– +3H2O = 2MnO2 + (8OH– + 6H+) + 3SO42–
2K+ 6Na+ 6H2O+2OH– 6Na+
2K+
2KMnO4 +3 Na2SO3 + H2O = MnO2 ↓+ 3Na2SO4 + 2KOH
в) щелочная среда (KOH)
KMnO4 + Na2SO3 + KOH = K2MnO4 + Na2SO4 + H2O
роз.-фиол. щелоч. зеленый
2│MnO4‾ + 1ē = MnO42–
1│SO32– + 2OH––2ē = SO42– + H2O
2MnO4‾ + SO32– + 2OH– = 2MnO42– + SO42– + H2O
2К+ 2Na+ 2К+ = 4К+ 2Na+
2KMnO4 + Na2SO3 + 2KOH = 2K2MnO4 + Na2SO4 + H2O