
- •Урок 108-109. Теплоемкость газов и твердых тел.
- •1. Количество теплоты и удельная теплоемкость.
- •2. Уравнение теплового баланса.
- •3. Теплоемкость идеального газа при постоянном объеме.
- •4. Распределение энергии по степеням свободы.
- •5. Теплоемкость много атомных газов.
- •6. Теплоемкость идеального газа при постоянном давлении.
- •7. Работа при адиабатном процессе.
- •8. Уравнение Пуассона.
- •9. Теплоемкость твердых тел.
5. Теплоемкость много атомных газов.
Двух атомная молекула, кроме трех степеней свободы поступательного движения, обладает еще двумя степенями вращательного движения, так как может совершать вращение вокруг двух взаимно перпендикулярных осей.
Вращением
вокруг третьей оси проходящей через
центры атомов можно пренебречь, как мы
это делали для одноатомного газа, получая
при этом хорошие результаты. Итак, у
двух атомной молекулы 5 степеней свободы.
Если предположить, что по-прежнему на
каждую степень свободы приходится
кинетическая энергия, равная
,
мы получаем, что энергия двухатомной
молекулы равна:

Молекулы,
состоящие более чем из двух атомов
обладаю тремя вращательными и тремя
поступательными степенями свободы. Для
газа с числом степеней свободы i,
кинетическая энергия равна:
 .
Тогда для удельной теплоемкости мы
получим выражение:
.
Тогда для удельной теплоемкости мы
получим выражение:
 .
Если вычислить теплоемкости газов с
учетом того выражения мы получим
результаты представленные в третьей
сроке таблицы. Хорошее согласие с
экспериментом подтверждает наше
предположение о распределении энергии
по степеням свободы молекулы.
.
Если вычислить теплоемкости газов с
учетом того выражения мы получим
результаты представленные в третьей
сроке таблицы. Хорошее согласие с
экспериментом подтверждает наше
предположение о распределении энергии
по степеням свободы молекулы.
6. Теплоемкость идеального газа при постоянном давлении.
Используя
первый закон термодинамики, получим:
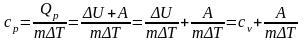 .
.
Работа
идеального газа при изобарном процессе
определяется выражением: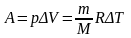 .
Отсюда для удельной теплоемкости
идеального газа при постоянном давлении
получаем:
.
Отсюда для удельной теплоемкости
идеального газа при постоянном давлении
получаем:

Теплоемкость
одного моля вещества называется молярной
теплоемкостью С:
 .
Следовательно молярные теплоемкости:
.
Следовательно молярные теплоемкости:
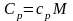
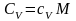 связаны уравнением:
связаны уравнением:
 .
Это уравнение впервые в 1845 году получил
Майер.
.
Это уравнение впервые в 1845 году получил
Майер.
7. Работа при адиабатном процессе.
Работа
идеального газа при адиабатном расширении
равна изменению его внутренней энергии,
взятому с противоположным знаком:
 .
Для одного моля идеального газа работа
равна:
.
Для одного моля идеального газа работа
равна: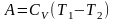
Из
уравнения состояния идеального газа
для одного моля выразим температуру:
 или
или .
Подставив Т в выражение для работы,
получим окончательно:
.
Подставив Т в выражение для работы,
получим окончательно: .
Отношение теплоемкостей
.
Отношение теплоемкостей
 называется коэффициентом Пуассона.
называется коэффициентом Пуассона.
Его
можно выразить через число степеней
свободы:
,
а удельная теплоемкость при постоянном
давлении равна:

Окончательно
для коэффициента Пуассона имеем:

Применив
коэффициент Пуассона к выражению для
работы газа при адиабатном расширении
получим:
 .
.
8. Уравнение Пуассона.
Как
известно, соотношение между давлением
и объемом идеального газа при изотермическом
процессе выражается законом Бойля-Мариотта.
Графически это – гипербола в осях р-V.
Соотношение давления и объема при
адиабатном процессе иное:
 .
Это выражение называется уравнением
адиабаты или уравнением Пуассона.
Используя уравнение состояния идеального
газа, можно уравнение адиабаты записать
еще в двух видах:
.
Это выражение называется уравнением
адиабаты или уравнением Пуассона.
Используя уравнение состояния идеального
газа, можно уравнение адиабаты записать
еще в двух видах:
 и
и

9. Теплоемкость твердых тел.
Тепловое
движение частиц, из которых состоят
кристаллы, в основном сводится к
колебаниям частиц около положения
равновесия, так как в твердом теле в
отличие от газа велика потенциальная
энергия взаимодействия атомов и молекул.
Как и у тела совершающего гармонические
колебания
средние значения изменений кинетической
и потенциальной энергии частицы в
твердом теле одинаковы. На одну степень
свободы колебательного движения
приходится энергия в два раза большая,
чем на одну степень свободы поступательного
движения, т.е. 2◦ .
.
Полная
энергия колебательного движения одного
атома равна
 .
Следовательно, изменение внутренней
энергии одноатомного твердого тела при
изменении его температуры равно:
.
Следовательно, изменение внутренней
энергии одноатомного твердого тела при
изменении его температуры равно:
 .
Пренебрегая работой при изменении
объема твердого тела, можно считать,
что удельная теплоемкость вещества в
твердом состоянии равна:
.
Пренебрегая работой при изменении
объема твердого тела, можно считать,
что удельная теплоемкость вещества в
твердом состоянии равна:
 .
Молярная теплоемкость вещества в твердом
состоянии равна
.
Молярная теплоемкость вещества в твердом
состоянии равна
 .
Этот вывод сделанный на предположении
о справедливости для твердых тел закона
равнораспределения энергии по степеням
свободы, подтверждается результатами
многих экспериментов для веществ в
твердом состоянии, в частности для
металлов. Равенство молярных теплоемкостей
различных элементов в твердом состоянии
было установлено французскими физиками
Дюлонгом и Пти, закон Дюлонга – Пти.
.
Этот вывод сделанный на предположении
о справедливости для твердых тел закона
равнораспределения энергии по степеням
свободы, подтверждается результатами
многих экспериментов для веществ в
твердом состоянии, в частности для
металлов. Равенство молярных теплоемкостей
различных элементов в твердом состоянии
было установлено французскими физиками
Дюлонгом и Пти, закон Дюлонга – Пти.
Рассмотренная классическая теория теплоемкости твердых тел является лишь грубым приближением к реальности. Основные особенности поведения твердых тел в процессах теплопередачи объясняются с помощью квантовой теории строения вещества.
Д.З.§32 + задача 32.1, 32.2.
