
- •Урок 108-109. Теплоемкость газов и твердых тел.
- •1. Количество теплоты и удельная теплоемкость.
- •2. Уравнение теплового баланса.
- •3. Теплоемкость идеального газа при постоянном объеме.
- •4. Распределение энергии по степеням свободы.
- •5. Теплоемкость много атомных газов.
- •6. Теплоемкость идеального газа при постоянном давлении.
- •7. Работа при адиабатном процессе.
- •8. Уравнение Пуассона.
- •9. Теплоемкость твердых тел.
3. Теплоемкость идеального газа при постоянном объеме.
Количество теплоты, передаваемое телу при теплопередаче, не определяет однозначно температуру тела, так как внутренняя энергия может изменяться и за счет совершения над ним работы. Поэтому удельная теплоемкость не является неизменной характеристикой вещества, а зависит от условий, при которых происходит передача тепла. Для идеального газа мы можем рассчитать теплоемкость теоретически.
Давайте рассмотрим случай передачи тепла идеальному газу при условии неизменности занимаемого объема – изохорный процесс. Поскольку работа, совершаемая в данном случае над газом внешними силами равна нулю, то удельную теплоемкость газа можно найти, вычислив изменение внутренней энергии газа массой 1 кг при изменении температуры на 1 К, используя выражение .
Будем
исходить из того, что внутренняя энергия
одноатомного идеального газа равна
сумме кинетических энергий теплового
движения молекул и может быть найдена
как произведение средней кинетической
энергии теплового движения молекул
умноженной на число молекул N: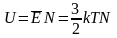 .
Изменение внутренней энергии идеального
газа при увеличении его температуры на
ΔТ определится выражением:
.
Изменение внутренней энергии идеального
газа при увеличении его температуры на
ΔТ определится выражением:
 .
.
Тогда
теплоемкость равна:
 , где M
– молярная масса газа.
, где M
– молярная масса газа.
Для того чтобы убедиться в пригодности полученного результата, сравним удельные теплоемкости газов рассчитанные по формуле и полученные экспериментально.
Сравнение расчетных и экспериментальных значений удельных теплоемкостей при постоянном объеме показывает хорошее согласование для гелия и аргона. У других газов теплоемкости, полученные в результате эксперимента, оказались значительно больше тех значений, которые предсказывает теория, основанная на модели одноатомного идеального газа.
способ получения сv |
Водород |
Гелий |
Азот |
Аргон |
Углекислый газ |
|
0,62·104 |
3,1·103 |
4,45·102 |
3,1·102 |
2,8·102 |
сv-эксперимент |
1,01·104 |
3,2·103 |
7,5·102 |
3,2·102 |
6,3·102 |
|
1,04·104 |
3,1·103 |
7,4·102 |
3,1·102 |
5,7·102 |
Чем же отличаются гелий и аргон от остальных газов? И гелий, и аргон являются инертными газами и имеют полностью заполненные электронные оболочки. Поэтому силы взаимодействия между атомами настолько малы, что при нормальных условиях они, в отличие от других газов, даже не образуют молекул, а остаются в атомарном состоянии. Напротив, водород, азот и углекислый газ – это молекулярные газы. Почему же реальная теплоемкость молекулярных газов больше расчетной. Зачем нужно дополнительное тепло, чтобы повысить температуру молекулярных газов на столько градусов, как и атомарных. Попробуем ответить на тот вопрос.
4. Распределение энергии по степеням свободы.
До
сих пор при рассмотрении свойств
атомарных и молекулярных газов, мы
учитывали только кинетическую энергию
поступательного движения. Кинетическая
энергия вращательного движения считалась
при том пренебрежимо малой по сравнению
с поступательной. И для одноатомных
газов мы получали хорошее совпадение
с экспериментом. Иное дело, когда мы
сталкиваемся с многоатомными молекулами.
В данном случае кинетическая энергия
вращательного движения равная
 уже будет существенно выше, так как
вырастает момент инерции.
уже будет существенно выше, так как
вырастает момент инерции.
Введем
понятие степени свободы тела. Степенью
свободы тела называется любое независимое
движение, которое оно может совершать.
В прямоугольной системе координат
состояние точки задается тремя
координатами и тремя проекциями вектора
скорости на эти координаты. Очевидно,
что одноатомные молекулы в пространстве
имеют только три степени свободы,
перемещение вдоль каждой координаты
независимо от перемещения вдоль других
координат. Так как движение газа
совершенно хаотично, квадраты проекций
скорости на каждую ось в среднем буду
одинаковы: .
Отсюда следует, что и поступательная
кинетическая энергия, приходящаяся на
каждую степень свободы в среднем
одинакова. Так как средняя кинетическая
энергия равна
.
Отсюда следует, что и поступательная
кинетическая энергия, приходящаяся на
каждую степень свободы в среднем
одинакова. Так как средняя кинетическая
энергия равна
 ,
то энергия приходящаяся на одну степень
свободы равна
,
то энергия приходящаяся на одну степень
свободы равна



