
- •Трансаминирование аминокислот: механизм, коферменты, значение. Что такое непрямое дезаминирование и его значение? Активность каких трансаминаз возрастает в сыворотке крови и при каких заболеваниях?
- •Как утилизируется азот аминогрупп аминокислот при их катаболизме? в результате чего может иметь место гипераммониемия? Что такое остаточный азот, чему он равен в норме и почему может возрастать?
- •Переваривание белков в кишечнике: условия, действующие ферменты и их специфичность, всасывание. Парентеральное питание – для чего используется и что при его осуществлении применяется?
- •Показать превращения аминокислот фенилаланина и тирозина, указать промежуточные продукты на путях, ведущих к образованию катехоламинов, йодтиронинов и меланинов.
- •Назвать аномальные компоненты желудочного содержимого и мочи, связанные с обменом белков. Как они обнаруживаются?
- •I стадия синтеза умф вкл катализируемое цитоплазматической карбамоилфосфатсинтетазой образование карбамоилфосфата из глутамина..
Переваривание белков в кишечнике: условия, действующие ферменты и их специфичность, всасывание. Парентеральное питание – для чего используется и что при его осуществлении применяется?
Перев-ие белков в кишечнике. Осущ-ся в тонком киш-ке,где д-ют ферменты панкреатического и кишечного соков.Трипсин и химотрипсин д-ют на белки аналогично пепсину,оба фермента наиб активны в слабощелочной среде(рН 7,2-7,8).Благодаря гидролит-му д-ию всех 3 эндопептидаз образ-ся пептидазы и некот-ое кол-во своб-ых АК.Дальнейший гидролиз пептидов до своб-ых АК осущ-ся под влиянием пептидаз.Помимо панкреатической карбоксипептидазы,на пептиды д-ют кишечная аминопептидаза и разнообраз-ые дипептидазы. аминопептидаза влияетна пептидную связь с N-конца пептида,карбоксипептидаза раз-ет пептидную связь с против-го С-конца пептида. Эти фермернты отщеп-ют по 1 АК от пептида и в конце ост-ся дипептиды,на кот-е д-ют дипептидазы и образ-ся свобод АК,кот –е затем вса-ся. Эластаза и коллагеназа подж. жел-зы гидрол.-ют эластин и коллаген. Парентеральное питание-приводит к развитию сенсибилизации(повыш-ой чув-ти организма к чуж-му белку),а повторное введение белков может привести к анафилаксии. Но к такому методу введения белков вынуждены прибегать при непрходимости пищевода из-за ожогов,отравлений,при раке пищ-да и желудка,после операций на ЖКТ.Для предотвращения осложнений исп.ют гидролизаты белков(смесь АК),такое введение не выз-ет аллергии,т.к. АК не обладают тканевой специф-тью, Но есть риск нарушения психической деятельности.
Показать превращения аминокислот фенилаланина и тирозина, указать промежуточные продукты на путях, ведущих к образованию катехоламинов, йодтиронинов и меланинов.
Фенилаланин-незаменимая аминокислота(ткани живот.не способны синтез-ть его бензольн.кольцо).Тирозин заменим при достаточ. поступл.первого с пищей.Основн.путь превращ.фенилаланина нач-ся с его гидроксилир-я(ферм-т – фенилаланин-4-монооксигеназа).При наруш.синтеза этого фермента в печени данная реакция блокир-ся =>развив-ся тяжел.наследст.болезнь-фенилкетонурия(замедл.умствен.развит,выдел.с мочой больш.кол-ва фенилпировиноград.к-ты,фенилал.накап-ся в тк.).В процессе трансаминир-я тирозин превр-ся в п-оксифенилпировиноградн.к-ту,котор.под действием спец. Оксидазы превр-ся в гомогентизиновую к-ту.последняя под действием оксидазы гомогент-ой к-ты превр-ся в малеилацетоуксусную к-ту,кот.прев-ся в фумарилацетоуксусную к-ту под действием изомеразы.
(промежут.продукты на рис.)
Фенилаланин и тирозин яв-ся предшест-ми меланинов.в этом важ.процессе приним-т участ.фермент-тирозиназа.при потере способности синтез-ть его возник-т альбинизм-врожден.отсутст.пигментов в коже и т.д.
Алкаптонурия харак-ся выдел-м с мочой больш.кол-ва гомогентиз-ой к-ты(темн.окраска).при болезни набл-ся отложен.пигмента в тк.,потемнен.носа,ушей,склеры.дефект связан с врожд.отсутст.в печени и почках оксидазы гомоген-ой к-ты.
При наруш.обмена триптофана возник-т болезнь Хартнупа.(кожн.пораж.,псих.расстройства,атаксия-повыш.выделение с мочой индолилацетата)
Болезнь кленового сиропа(выдел-ся также индолилацетат и индолилмолоч.к-та)
Цистинурия-насл.забол.,выдел-ся с мочой в 50 раз > нормы кол-ва 4 аминок-т:цистина,лизина,аргинина,орнитина.(люди здоровы,но есть тенденция к образ-ю в орг-ме камней).
Болезнь Вильсона-наруш.синтеза церулоплазмина.
Цистиноз-врожд.наруш.реабсорбции почти всех аминок-т.
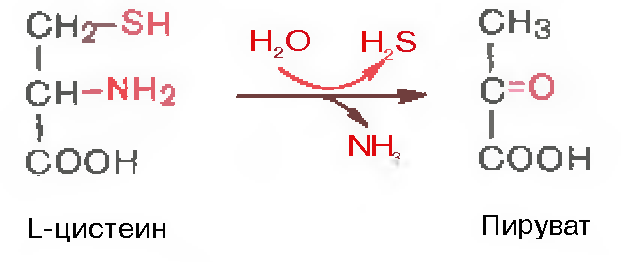
.Дезаминирование аминокислот - показать уравнения возможных реакций и указать названия получающихся продуктов. Какое дезаминирование преобладает в организме человека? В чем заключается связь дезаминирования и трансаминирования?

Продуктами дезаминирования кроме аммиака(идет в мочевину) являются жирные к-ты, оксик-ты, кеток-ты(идут в цикл кребса)
Для орг-ма чел преобладающ типом реакции явл-ся окислительное дезаминир-е, за искл гистидина(внутримолекулярн дезаминир-е)

биосинтетического процесса.
. Перечислить незаменимые аминокислоты, объяснить причину их незаменимости. Что такое полноценные и неполноценные белки? Указать величину суточной потребности в пищевом белке, от чего она зависит? Какие изменения и заболевания могут быть при недостаточном белковом питании?
Аргинин, валин, гистидин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин.
Незаменимость указанных аминок-т для роста и развития орг-ма жив-х и чел-а связана с отсутствием способности тканей синтезировать углеродные скелеты незаменимых аминок-т, поскольку процесс аминирования соответствующих кетопроизводных осуществляется сравнительно легко посредством реакций трансаминирования. Следовательно все эти аминок-ты должны поступать с пищей.
Полноценные белки содержат весь набор незаменимых аминокислот
Нормы белка в питании учитывают разные климат условия, условия труда, профессию, возраст и др. Взрослый человек, занимающ умств трудом при средней физ нагрузке должен получать 100-120 г белка в сутки при энерго тратах 12000 кДж. При изменении условий труда эта норма белка увелич на 10 г на каждые 2100 кДж.
Белковая недостаточность у человека развивается при полном и частичном голодании, а также при однообразном белковом питании, когда в диете преобладают белки растит происхождения. Результатом этих состояний явл-ся развитие отрицат азотистого баланса, гипопротеинемии, нарушения коллоидно-осмотического и водно-солевого обмена ( развитие отеков). При тяжелых формах пищ дистрофий, н-р, квашиоркоре – наблюдаются тяжелые поражения печени, остановка роста, резкое снижение сопротивляемости орг-ма инфекциям, отечность, атония мышц, часто с летальным исходом.
