
Нуклеопротеины, нуклеокислоты.
Строение, роль, функции:
Нуклеопротеины - это сложные белки, простатическая группа у которых представлена нуклеиновыми кислотами. Белковая часть представлена белками, основного характера двух типов:
протамины: белки с молекулярной массой от 4-12 тысяч. Проявляют выраженные основные свойства, так как содержат 70-80% основных аминокислот (арг, лиз), встречаются в нуклеопротеинах, только у некоторых сортов.
Гистоны: так же с низкой молекулярной массой от 11 – 21 тыс. содержат 20-30% основных аминокислот, т.е. так же носят основной характер. Белки гетерогенные и их делят на 5 фракций, в зависимости от содержания арг, лиз, сер: Н1, Н2А, Н2В, Н-3, Н-4.
Все фракции содержаться в равном количестве, только Н1 в два раза меньше. Эти белки входят в нуклеопротеины (НП) человека, животных и растений. У некоторых вирусов могут входить белки типа альбуминов.
Нуклеиновые кислоты: высокополимерные соединения, состоящие из мономеров – мононуклеотидов. Каждый нуклеотид из трех обязательных компонентов: азотистое основание. Углевод, остаток фосфорной кислоты.
Азотистое основание: представлено производными путинов и перемединов.
 ↔
↔

гуанин (2-амино, 6-гидрокси-пурин) (2,4-дигидрокси-перемидин)

аденин (6-аминопурин)

пурин

перемидин урацил тимидин цитадин
↓↑ ↓↑ ↓↑

углевод представлен D-рибозой или D-дезоксирибозой.
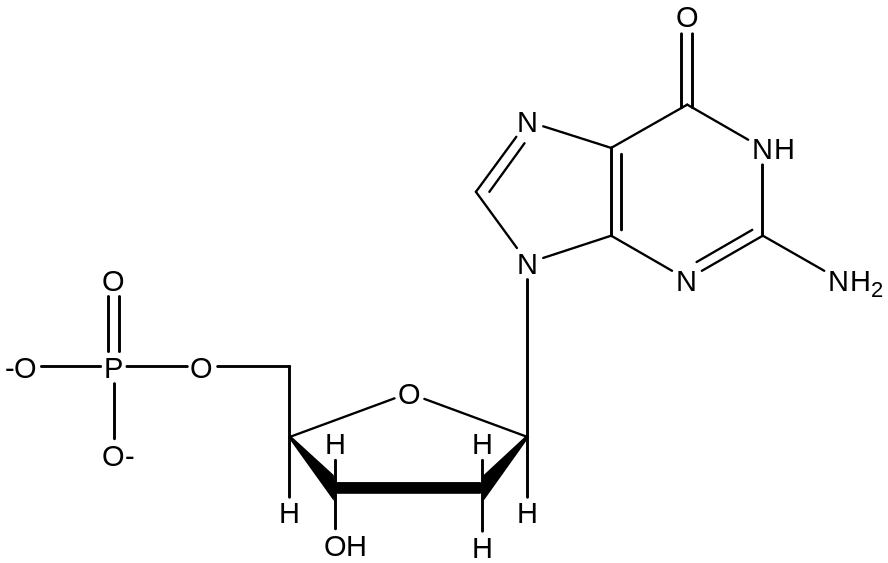
гуаниловый нуклеотид (ГМФ)

тимидиновый нуклеотид
всегда с дезоксирибозой.
В нуклеиновых кислотах нуклеотиды соединены 3’,5’-фосфодиэфирными связями.
Типы нуклеиновых кислот: в живых организмах обнаружено 2 типа нуклеиновых кислот: ДНК и РНК.
ДНК: локализована в ядре клеток. 0,1-0,2% в митохондриях. Азотистые основания представлены АГЦТ, углевод дезоксирибоза. Молекулярная масса очень большая, так как содержит от 10000 до 1000000 нуклеотидов. При изучении нуклеотидного состава ДНК Чаргафф вывел закономерности, которые названы правилами Чаргаффа.
1. сумма пуриновых оснований равна сумме перемидиновых оснований.
А + Г = Ц + Т
А + Г / Ц + Т = 1
2. сумма Аденина равна сумме Тимина
сумма гуанина равна сумме цитозина
А = Т * А / Т = 1
Г = Ц * Г / Ц = 1
3. сумма А + Ц равна сумме Г + Ц
А + Ц / Г + Т = 1 → А + Ц = Г + Т именно этот закон объясняет свойства комплиментарности.
4. нуклеотидный состав ДНК у разных организмов характеризуется отношением Г + Ц / А + Т
это отношение называют коэффициент специфичности.
Этот коэффициент у эукариот (высших организмов) меньше 1, у прокариот больше 1.
Вторичная структура: изучена методом рентгеноструктурного анализа (РСА) Уотсоном и Криком.
Молекула ДНК представляет собой двойную спираль образованную двумя полинуклеотидными цепями, расположенными анти параллельно. Спираль имеет определенные размеры: высота одного витка 3 - 4 нм. В виток укладывается 10 пар нуклеотидов, т.е. высота одного нуклеотида 0,3-0,4 нм. Спираль жесткая структура и удерживается двумя типами связей:
1. водородными связями между азотистыми основаниями А = Т, Г = Ц.
это взаимодействие оснований получило название комплементарности.
2. силами гидрофобного взаимодействия между азотными основаниями (стэкинг-взаимодействия).
Порядок расположения нуклеотидов в ДНК.
Может быть разным, но последовательность нуклеотидов в одной цепи всегда определяет последовательность нуклеотидов во второй цепи, благодаря свойствам в комплементарности.
Третичная структура: может быть представлена палочкой, кольцом, суперспиралью.
Уровни комбоктизации ДНК в хромосоме:
Выделяют три уровня:
в нем участвует по две молекулы белков, гистонов Н2А, Н2В, Н3, Н4, которые образуют диск с диаметром 10 нм. Вокруг которого наматывается нить ДНК 13/4 оборота. Такая структура называется нуклеосома. При этом длинна ДНК уменьшается в 7 раз.
В нем участвуют белки Н1. они образуют цилиндр, вокруг которого наматывается нить ДНК в виде спирали с нуклеосомами. На один виток этой спирали приходится 6 нуклеосом. Эта структура называется соленоид и длина молекулы сокращается в 6 раз.
В нем принимают участие негистоновые белки, которые служат основой для прикрепления ДНК в виде петель и длинна молекулы сокращается в 400-800 раз.
РНК: в клетках содержится 3 главных вида РНК. Это:
и-РНК (информационная)
т-РНК (транспортная)
р-РНК (рибосомная)
Кроме этого выделяются гя-РНК – гетерогенная ядерная, мя-РНК – малая ядерная.
Первичная структура: молекулы РНК – одноцепные. В их состав входит АГЦУ, углевод – рибоза.
и-РНК: молекулярная масса 23000 до 30000. содержит 70-100 нуклеотидов, но 10% из них являются минорными (редко встречаются). Это метилированное основание и они способны образовавыть водородную связь всего выделено 61 т-РНК. Локализовано в цитозоле клеток. У всех т_РНК на 3’ конце имеется триплет (сочетание 3 нуклеотидов ЦЦА) и этот конец называется акцепторным. Так как к нему к гидроксилу (ОН) третьего атома углерода рибозы адинолого нуклеотида присоединяется аминокислота.
Функция т_РНК: транспорт аминокислот к рибосоме. На 5’ конце у всех т-РНК находится гуаниловых нуклеотид.
р-РНК:находится в рибосомах, в клетках содержится от 5000 до 10000 робосом. У эукариот рибосомы крупные и состоят на 50% из белка и 50% р-РНК (бактерии 60 % р-РНК и 40% белка). Каждая рибосома состоит из двух субъединиц: малой и большой. При ультрацентрифугировании константа седиментации (скорость оседания) у рибосом прокариот 70 S, у эукариот 80 S → единица Сведберга = 1,10 -13 сек.
Прокариот эукариот
70 S 80 S
(м) 30 S 50 S (б) (м) 40S 60 S (б)
(м) 16 S 23 S (б) (>1мкл) (м) 18S 28S (б)
(до 4 мкл 1,3-1,4 мкл
~ 750000)
5 S (б) (40000) 5 S (б)
5,8 S (б) (45000)
роль р-РНК: она является остовом (основа) рибосомы к которому прикрепляются белки.
Вторичная структура РНК: представлена отдельными участками спирализации. Вторичная структура у т-РНК в виде клеверного листа.

Из-за большего числа минорных оснований образуется три петли, напротив акцепторного конца находится петля, имеющая триплет соответствующий кодону и-РНК, антикодон, поэтому петля антикодона строго специфична. Вторая петля одинаковая у всех т-РНК (псевдоуридиловая), служит для прикрепления к рибосоме – уневирсальная петля.
Третья петля (дигидроурединовая), строгоспецифичная и служит для прикрепления фермента амино-ацил-т-РНК-синтетазы (АРАС-аза).
Третичная структура РНК: в виде клубка или палочки у т-РНК в виде буквы Г.
Синтез пуриновых нуклеотидов: происходит на фосфорелированной углеводе рибоза-5-фосфат, образуется в пентозном цикле и фосфорелируется за счет АТФ по 1-ому углеводному атому 5-фосфорибозилкиназа образуется 5-фосфорибозил-1-пирофосфат.
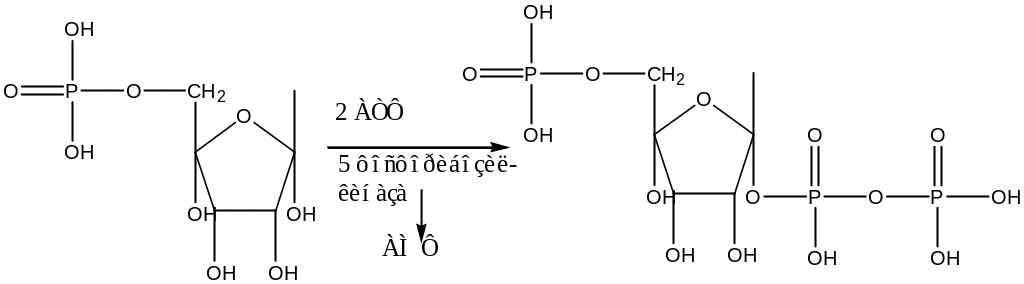 5-фосфорибозил-1-пирофосфат. (α)
5-фосфорибозил-1-пирофосфат. (α)

5-фосфорибозиламин (*) (β)
произошла изомеризация α в β.
(*) его азот будет девятым атомом в пуриновой кислоте.

К 5-фосфорибозиламиду присоединяется глицин (4,5,7) за тем метенилТГФК (8), затем глн (N3), СО2 (6), аспарагиновая кислота (N1), формилТГФК (2).
В итоге получается инозиновая кислота, промежуточный продукт синтеза, из которой образуется и адиниловые и гуаниловые нуклеотиды.

инозиновая кислота
 АМФ
ксантиловая кислота
АМФ
ксантиловая кислота
↓ + глн + АТФ
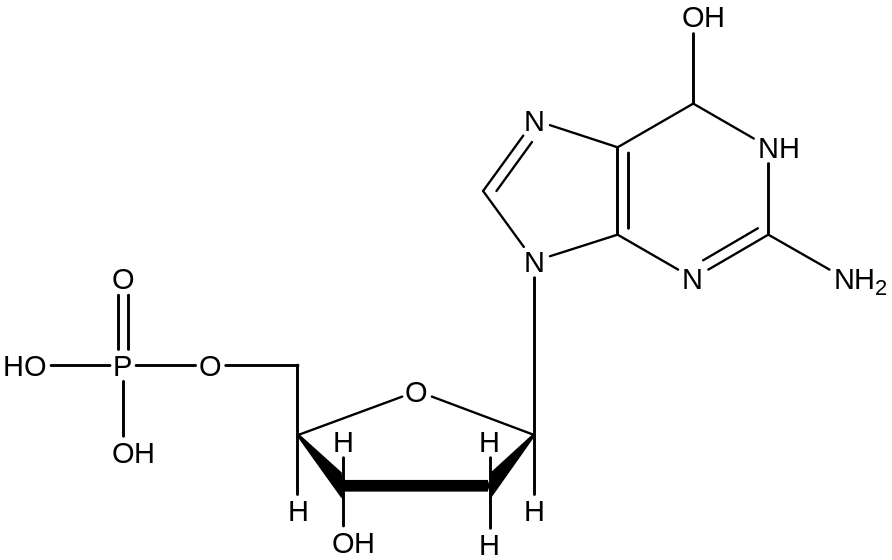
ГМФ
Синтез перемидиновых нуклеотидов:
Отличается тем, что в начале синтезируется перемидиновое кольцо, а к нему присоединяется фосфорелированный углевод.
Синтез происходит из СО2, глн, с затратой АТФ в результате чего образуется каробомоил фосфат и глутаминовая кислота.
Процесс идет под действием фермента карбомоил фосфатсинтетазы в ядре.
СО2 + глн + 2 АТФ + Н2О → NH2-C-O~PO3H2 + глу + 2 АДФ + Н3РО4
||
O
ГЛН:

Карбомоилфосфат взаимодействует с асп кислотой
N H2-C-O~PO3H2
+ COOH + H2O
H2-C-O~PO3H2
+ COOH + H2O
|| | ––––––→
O CH2 ↓
| H3PO4
CH–NH2
|
COOH
карбамоиласпартат
–––––→
- H2O

дигидрооротовая кислота оротовая кислота
5-фосфорибозил-
1-пирофосфат
––––––––––––––→
↓
2 Н3РО4 оротидиловая кислота


→
 тимидиловая
кислота ТМФ
тимидиловая
кислота ТМФ
Распад пуриновых нуклеотидов.
АМФ
↓→ Н3ро4
аденозин
↓→ NH3
 инозин
инозин
↓→ рибоза
 гипоксантин
гипоксантин
↓ [О] ксантиноксидаза микросомальное окисление\

ксантин
↓ [О] ксантиноксидаза

мочевая кислота.
ГМФ
↓→ Н3РО4
гуанозин
↓→ рибоза

↓→ NH3
ксантин
Конечным продуктом распада пуриновый нуклеотидов является мочевая кислота.
Она образуется в основном в печени. В сутки в норме с мочой выделяется 0,3-1,2г. В среднем 400-600 мг.
В крови содержание мочевой кислоты в норме 0,12-0,24 ммоль/л. Оно может увеличиваться. Это приводит к заболеванию подагре.
Мочевая кислота может находится в свободной форме и в виде солей урата натрия.
Соль в 17 раз лучше растворима в воде, чем кислота.
В организме при нашем значении рН = 7,36± 0,45 мочевая кислота находится в виде соли, а при подкислении среды < 5,75 она переходит в свободную форму и кристаллы кислоты откладываются в хрящах, сумках суставов и развивается подагрический артрит (боль, деформация суставов).
Лечение: соблюдение деты бедной пуринами (нельзя есть мясо, кофе, шоколад, чай, помидоры, щавель).
 препарат
препарат
аллопуринол ингибирует ксантилоксидазу.
Распад перимидиновых нуклеотидов.
Происходит так же путем отщепления Н3РО4, углевода, а затем разрушение кольца до СО2 и NH3 и β-аланина.
Роль свободных нуклеотидов:
являются структурными мономерами при синтезе нуклеиновых кислот.
являются макроэргическими соединениями.
являются простетическими группами или коферментами ферментов.
являются посредниками (ц-3’,5’-АМФ, ц-3’,5’-ГМФ) в действии гормонов.
Синтез ДНК: передача генетической информации происходит следующим путем:
от ДНК к ДНК – репликация.
от ДНК к РНК – транскрипция.
от РНК к белку – трансляция.
ДНК → ДНК репликация
↓
РНК транскрипция
↓
белок трансляция
основной закон молекулярной биологии.
Репликация: (образование точной копии).
В 1957г Мезельсон и сталь экспериментом подтвердили гипотезу Уотсона и крика о том, что репликация происходит полуконсервативным способом, т.е. радительская ДНК раскручивается на 2 цепи, на каждую из них синтезируется новая цепь по принципу комплементарности. В результате образуется две новых молекулы ДНК в каждой из них осталась одна родительская цепь ДНК. Клетки эшерихии коли (E.Coli) выращивали на питательной среде, содержащей NH4Cl с N15 все соединения в клетках содержали N15, затем клетки перенесли на питательную среду с обычным азотом и дали время для одного деления. Анализ ДНК показал, что в каждой молекуле ДНК одна нить содержит N15 и одна N14. клеткам дали время еще для одного деления. Получились два типа молекул ДНК. Одни содержали цепь N15 и N14, другие молекулы содержали только N14.

синтез ДНК происходит в ядре клеток с участием большого количества ферментов и белковых факторов. Осуществляется ДНК полимеразами, которые есть трех видов (у прокариот I, II, III, у эукариот α, β, γ).
Эти ферменты требуют определенные условия:
наличие ДНК как матрицы,
наличие четырех типов дезоксирибонуклеозидтрифосфатов.
Процесс происходит в несколько стадий:
инициации (начало): репликация начинается сразу в нескольких точках ДНК – точках инициации, так как молекула ДНК очень большая и потребовалось много времени для ее синтеза . в точке инициации к ДНК присоединяется ДНК-раскручивающих белок (Хеликаза). Он расплетает молекулу ДНК, разрывая водородные связи. На каждую пару оснований затрачивается 2 АТФ. Хеликазе помогает фермент гираза, которая устраняет отрицательные витки. На каждую цепь присоединяются ДНК-связывающие белки, которые не дают образовываться водородным связям. Снова в результате образуется репликационный пузырь, который состоит из двух репликационных вилок, направленных в противоположно. На 5’ цепь в репликационной вилке в точке инициации присоединяется фермент РНК-полимераза-проймаза, которая по принципу комплиментарности синтезирует маленькую молекулу РНК – проймер. Он содержит от 10 до 50 рибонуклеотидов. Синтез идет в направлении 5‘ → 3’, из АТФ, ГТФ, ЦТФ и УТФ. Синтезом проймера заканчивается стадия инициации.
илонгация (удлинение). Проймер служит затравкой и к его 3‘-концу ДНК-полимераза III присоединяет дезоксирибонуклеотиды и по принципу комплементарности синтезирует новую цепь ДНК в направлении 5‘ → 3’ и непрерывно. Проймер необходим ДНК-полимеразе III. Так как в начале она должна проверить правильность предыдущего нуклеотида (образовались ли водородные связи между этими нуклеотидами и материнской цепью ДНК. Если водородных связей нет ДНК-полимераза III отризает этот неправильный нуклеотид. Эта цепь ДНК называется лидирующей. К 5’-концу проймера присоединяется ДНК-полимераза I и по одному начинает удалять рибонуклеотид заменяя их дезоксирибонуклеотидами. Образуется кусочек ДНК соответствующий проймеру, но между ней и цепью ДНК получается дырка. Ее зашивает ДНК линаза. На 5’-цепи. Синтез дочерней цепи должен идти в направлении противоположном движению хеликазы. Синтез поэтому осуществляется фрагментами Оказаки, которые содержат у прокариот 100-2000 нуклеотидов, у эукариот 150-200. проймаза строит проймер, к нему ДНК-полимераза III присоединяет дезоксирибонуклеотиды. А ДНК-полимераза I удаляет проймер. Дырки между фрагментами сшивает ДНК-лигаза. Синтез этой цепи идет медленнее и она называется запаздывающая. Репликативные пузыри растут и сшиваются.
терминация (окончание): в каждом пузыре 4 кусочка ДНК, которые ДНК-лигаза сшивает и образуется две молекулы ДНК, каждая содержит родительскую цепь и дочернюю, вновь синтезированную.
Репарация ДНК: многие химические и физические факторы вызывают в ДНК повреждения: УФ, излучение, радиация, УЗ, азотистая кислота, алькилирующие вещества.
Эти повреждения могли бы привести к мутациям. Одна ко в живых организмах имеется механизмы исправления повреждений, т.е. репарационная система. В ней участвует ДНК-полимераза.
Нуклеаза разрезает цепь ДНК перед местом повреждения, а ДНК-полимераза вырезает поврежденный нуклеотид. Присоединяя по принципу комплементарности правильный нуклеотид к 3’-концу. Вырезается весь поврежденный участок, а концы сшивает ДНК-лигаза.
Транскрипция, синтез РНК: участок ДНК на котором синтезируется одна молекула РНК называется оперон у прокариот или транскриптон у эукариот. На ДНК синтезируются все виды РНК (и, т, р-РНК).
Оперон это единица транскрипции.
Процесс осуществляется РНК – полимеразами. Они требуют определенных условий для работы:
наличие ДНК как матрицы.
Наличие 4 видов нуклеозидтрифосфатов (АТФ, ГТФ, ЦТФ, УТФ).
Ионы магния.
Фермент состоит из нескольких субъединиц (2α-одинаковых, β и β’). Все вместе они образуют кофермент. К нему присоединяется σ-фактор, которым РНК полимераза прочно связывается с промотором ДНК.
В опероне имеется регуляторный участок и гены несущие информацию о структуре белка.
Оперон начинается с промотора, с которым связывается РНК-полимераза, за ним находится ген оператор, за геном оператором располагается структурные гены, в которых выделяют информативные участки (экзоны), в которых содержится информация о структуре белка и не информативные участки, расположенные между экзонами – энтроны. Роль их неизвестна, заканчивается оперон геном терминатор.
РНК-полимераза присоединяется к промотору и снимает полную копию с оперона, синтез идет в направлении 5’ → 3’
Начинается созревание РНК – процессинг. Синтезированная незрелая РНК называется пре-и-РНК (ГЯ). Не информативные участки пре-и-РНК вырезаются, происходит сплайсинтг. Для этого с помощью МЯ-РНК, пре-и-РНК складывается в виде петли, в которую входит не информативный участок.

фермент нуклеаза отрезает петлю, а лигаза сшивает концы. Образуется и-РНК, затем происходит ее защита: к 5’-концу и –РНК присоединяется КЭП-участок (7-метил-гуанозил). Он обеспечивает прикрепление и-РНК к рибосоме.
К 3’-концу присоединяется полиадениловая последовательность (поли А) с помощью, которой и-РНК присоединяется к белку информоферу и наматывается на него. В таком виде и-РНК поступает к рибосоме.
Обратная транскрипция: в 1969 – 1970 из ткани инфецированных онкогенами водорослей (вызывающие рак) были выделены ферменты способные синтезировать ДНК на матрице РНК. Ферментами назвали обратными транскриптазами (ревертазы).
При попадании вируса в клетку хозяина РНК вируса является матрицей, на которой по принципу комплементарности эти ферменты синтезируют цепь ДНК. Образуется гибридная молекула. Затем эти ферменты разрушают РНК. А на цепи ДНК синтезируют вторую цепь и образуется вирусная ДНК. Она встраивается в геном клетки хозяина и вызывает перерождение клетки в раковую. Обнаружение обратных транскриптаз имеет важное значение для диагностики заболеваний – лейкемия.
Эти ферменты используются для синтеза ДНК на матрице и-РНК, т.е. так можно получить ген ДНК.

РНК РНК- транск- ДНК-
Виру- ДНК рипт вируса
СА ДНК
ОПЕРОН
3’ |
Ген регулятор |
|
промотор |
Ген- оператор |
|
Э |
Э |
|
Э |
|
Э |
|
Э |
Э |
Э |
Ген- терминатор |
5’ |
Г Я-пре-и-РНК
5’
Э
Э
Э
Э
Э
Э
Э
3’
И -РНК ↓
-
5’
Э
Э
Э
Э
Э
3’
↓
-
5’
кэп
Э
Э
Э
Э
Э
А
А
А
А
А
3’
↓

 информофер
информофер
↓


 эффектор
эффектор
белок-репрессор

Генетический код: вся информация о структуре белков в и-РНК зашифрована с помощью генетического кода, который имеет следующие характеристики:
код триплетен, т.е. каждая аминокислота закодирована комбинацией из трех нуклеотидов (УУУ) – фенилаланин.
вырожденность кода, все аминокислоты кодируются двумя и более триплетами, т.к. комбинации 43 = 64, а аминокислот 20. замена третьего нуклеотида в большинстве триплетов не изменяет смысл, в некоторых триплетах замена первого нуклеотида не изменяет смысл, но замена второго нуклеотида всегда влияет на смысл триплета. Таким образом вырожденность повышает устойчивость генетической информации к воздействию внешних факторов.
одна направленность чтения информации идет только в направлении 5’ → 3’.
специфичность кода, каждый триплет кодирует только одну аминокислоту.
2 триплета АУГ и ГУГ кодируют инициирующую аминокислоту формилметионина, если стоят в начале и-РНК.
три триплета УАА, УАГ, УГА не кодируют аминокислоты и являются терменирующими.
колинеарность, последовательность аминокислот в полипептидной цепи всегда соответствует последовательности триплетов в и-РНК.
неперекрываемость, каждый нуклеотид входит только в один триплет.
универсальность, код едины.
Генетическая информация от РНК к белку (трансляция):
Белки отличаются тем, что последовательность аминокислот в поли пептидной цепи определяет пространственную к/г молекулы, ее физико-химические свойства и следовательно функцию молекулы.
Стадия инициации


Процесс трансляции включает несколько стадий:
стадия активации аминокислоты: для этой стадии необходимо:
полный набор аминокислот (20)
полный набор т-РНК (61)
АТФ
Ферменты (аминоацил-т-рнк-синтетаза) (АРС-азы).
Магний (активатор ферментов).
АРС-азы – ферменты с 4-ой структурой, имеют 4 активных центра:
для аминокислот,
для АТФ
для т-РНК
для воды.
Ферменты обладают двойной специфичностью:
по отношению к т-РНК,
по отношению к аминокислотам.
В начале происходит процесс взаимодействия аминокислоты с АТФ.
R
|
NH2-CH-COOH + АТФ → H4P2O7

аминоациладенилат


+
 +
АТФ
+
АТФ
аминоацил-т-РНК
в 4-ом центре находится вода, т.к. фермент сам контролирует правильность соединения т-РНК с аминокислотой. При соединении неправильной аминокислоты, фермент гидролизует эту пару с помощью воды.
2. стадия инициации полипептидной цепи.
Необходимы:
и-РНК
большая и малая субъединицы рибосомы (30S и 50 S).
ГТФ
белковые факторы инициации JF-1, JF-2, JF-3.
инициирующая амино-ацил-т-РНК (формил-метионил-т-РНК).
Это метионин, у которого атом водорода в NH2-группе замещен формильным радикалом и поэтому аминогруппа не реакционно способна.
6. магний.
Стадия элангации.


В начале к 30 S субъединице присоединяется JF-3 и образуется комплекс. Одновременно белковый фактор JF-2 соединяется с ГТФ и образуется второй инициаторный комплекс, к которому присоединяется формил-метионин-т-РНК.
Эти два инициаторных комплекса соединяются.
Белковый фактор JF-3 осуществляет узнавание инициирующего кодона на и-РНК.
Белковый фактор JF-2 осуществляет присоединение 50S субъединицы рибосомы.
JF-1 способствует присоединению и-РНК. К комплексу присоединяется большая субъединица рибосомы за счет энергии ГТФ и все белковые факторы выделяются, т.к. произошла сборка рибосомы с и-РНК и формилмитианин-т-РНК.
В собранной рибосоме имеется 2 активных участка.
А- участок (аминоацил – имеет сродство к аминокислоте).
Р – участок (пептидный – имеет сродство к пептидам.
В Р-участке находится инициирующий кадон и-РНК АУГ и связывается с ним по принципу комплементарности антикодон формилметионин-т-РНК.
В А – участке стоит следующий кодон и-РНК и участок свободен → рибосома готова к работе.
3. стадия элонгации.
Для нее неиобходимы:
полный набор аминоацил-т-РНК.
ГТФ.
факторы элонгации EF – T, EF-G.
С затратой ГТФ и при помощи фактора EF-T в А-участок присоединяется аминоацил-т-РНК с комплементарным антикодоном.
Фермент пептидол-трансфераза снимает f-мет с т-РНК и присоединяет пептидную связь к стоящей рядом аминокислоте, образуется дипептид. На его образование (пептидную связь) затрачивается энергия макроэргической аминоацил-т-РНК, но пептид стоит в А-участке, у которого сродства к пептидам нет.
Силы гидрофобного взаимодействия тянут пептид с т-РНК в Р-участок и происходит его перемещение в р-участок вместе с кодоном и-РНК. Это перемещение называется транслокацией. В а-участок приходит новый кодон и-РНК и к нему может присоединится аминоацил-т-РНК с комплементарным антикодон, т.е. происходит повторение всех этапов элонгации.
Так происходит до тех пор пока в а-участок не приходит кодон терминации.
стадия терминации: необходимы:
1. белковые факторы Rf-1 (узнают кодоны УАА, УАГ), Rf-2 (узнают кодоны УАА, УАГ).
Белковые фракции узнают терминальные кодоны и изменяют к/м, в результате активируется фермент пептидилэстераза, которая отщепляет полипептидную цепь от последней т-РНК. Она уходит в цитоплазму. А весь комплекс распадается на и-РНК, 30-50S субъединицы рибосом и т-РНК.
Стадия посттрансляционных изменений полипептидной цепи: в цитоплазме происходит отщепление формилметионина с N-конца (метионил у эукариот) замыкаются дисульфидные связи (с участием ферментов) водородные связи, т.е. формируется вторичная, третичная и четвертичная структура.
К сложным белкам присоединяется не белковая часть (простетическая группа.
Образование полисом: и-РНК быстро распадается, потому что на нее садятся несколько рибосом, которые одновременно осуществляют синтез одинаковых полипептидных цепей.

такое образование называется полисома, рибосомы садятся с интервалом 3 нм.
Регуляция биосинтеза белков:
В основе регуляции лежит принцип репрессии (угнетения).
Кроме оперонов в ДНК имеются гены регуляторы для каждого оперона. Но ген регулятор находится на большом расстоянии от подчиненного оперона.
В покое все опероны заблокированы. На гене регуляторе синтезируется и-РНК, которая поступает к рибосоме и происходит синтез белка репрессии.
У него есть 2 центра: 1) для связывания с геном оператором подчиненного оперона, 2) для связывания с эффектором.
Роль эффектора могут играть субстраты, метаболиты, гормоны.
Первый центр связанный с геном оператором активен только если свободен второй центр. Репрессоры присоединены к генам операторам оперонов, и они заблокированы. При появлении эффектора в среде , эффекторы связываются с белком репрессором м к/м белка изменяется. Он отщепляется от гена оператора. К промотору присоединяется РНК-полимераза и происходит синтез и-рнк. Она поступает к рибосоме и идет синтез белка.
Синтез происходит до тех пор пока есть эффекторы. При расщеплении эффектора, репрессор изменяет к\м и снова присоединяется к гену оператор оперон блокируется. Синтез и-РНК и белка прекращается. Это теория Жикабо и Мано.
