
- •Биохимия
- •1.1. Белки. Аминокислоты -- структурные компоненты белков
- •Аминокислоты, содержащие неполярные r-группы.
- •Аминокислоты, содержащие полярные, неионные r-группы.
- •Аминокислоты с полярными отрицательно заряженными
- •Аминокислоты с полярными положительно заряженными r-группами.
- •1.3. Уровни структурной организации белковых молекул
- •1.4. Физико-химические свойства белков
- •1.5. Классификация белков
- •Характеристика простых белков.
- •1.6.1. Хромопротеины
- •1. Свободные липопротеины.
- •2. Структурные протеолипиды.
- •1.Свободные липопротеины.
- •2.Структурные липопротеины ( протеолипиды ).
- •Нуклеопротеины
- •1.6. Углеводы. Классификация углеводов
- •2.2. Моносахариды
- •2.3. Олигосахариды
- •2.4. Гомополисахариды (пс).
- •2.5. Гетерополисахариды
- •1.7. Липиды Липиды
- •4.1. Жирные кислоты и ацилглицеролы.
- •4.2. Фосфолипиды и сфинголипиды
- •4.2.1.Фосфолипиды
- •1.8.1. Жирорастворимые витамины
- •1.8.2. Водорастворимые витамины
- •1.8.3. Витаминоподобные вещества.
- •1.8. Витамины
- •Рацион взрослого человека
- •1.8.1. Жирорастворимые витамины
- •1.8.2. Водорастворимые витамины
- •1.8.3. Витаминоподобные вещества.
- •2.1. Ферменты и неорганические катализаторы
- •2.2. Строение ферментов
- •2.3. Коферменты
- •2.4. Свойства ферментов
- •2.5. Номенклатура ферментов
- •2.6. Классификация ферментов
- •2.7. Механизм действия ферментов
- •Это снижение каталитической активности в присутствии определенных веществ – ингибиторов.
- •1.Обратимые - это соединения, которые нековалентно взаимодействуют с ферментом, при этом образуется комплекс, способный к диссоциации.
- •3. Обмен углеводов
- •3.1. Биологическая роль углеводов
- •3.2. Превращение углеводов в пищеварительном тракте
- •3.3. Биосинтез и распад гликогена
- •3.4.1. Анаэробный гликолиз
- •3.4.2. Аэробный гликолиз (гексозодифосфатный путь)
- •3.4.2. Аэробный гликолиз (гексозодифосфатный путь)
- •3.4.3. Гексозомонофосфатный путь
- •3.4.4. Глюконеогенез
- •3. Глюконеогенез.
- •4.1. Основные липиды организма человека их биологическая роль.
- •4.2. Переваривание липидов, ресинтез жира
- •4.3. Липопротеины крови
- •4.4. Окисление высших жирных кислот
- •4.5. Окисление глицерина
- •4.6. Биосинтез вжк в тканях
- •4.7. Обмен холестерина
- •5.1. Переваривание белков
- •5.2. Гниение аминокислот, обезвреживание продуктов гниения
- •5.3. Метаболизм аминокислот
- •5.4. Пути обезвреживания аммиака
- •6. Регуляция обмена веществ
- •6.1. Сигнальные молекулы
- •6.2. Гормоны гипоталамуса
- •6.3. Гормоны гипофиза
- •6.3. Гормоны гипофиза
- •6.4. Гормоны щитовидной железы гормоны щитовидной железы
- •6.5. Гормоны паращитовидных желез гормоны паращитовидных желез
- •6.6. Гормоны половых желез
- •6.7. Гормоны надпочечников
- •6.8. Гормоны поджелудочной железы
- •7. Экзаменационные вопросы
1.6.1. Хромопротеины
Хромопротеины – это сложные белки, простетическая часть которых представлена окрашенным компонентом (от греч. Chromos – краска). К ним относятся биологически важные белки гемоглобин, миоглобин, а также некоторые ферменты: каталаза, пероксидаза, цитохромы, все они являются гемпротеинами, так как простетическая часть их содержит гем.
Гемоглобин (Нв).
Гемоглобин имеет четвертичную структуру, молекулярная масса его 66-68 тыс.Да. Как следует из названия Нв представляет собой соединение гема с белком глобином. Это олигомерный белок, состоящий из 4 субъединиц (протомеров), соединенных нековалентными связями (гидрофобные, ионные взаимодействия, водородные связи).
Субъединицы Нв «узнают» друг друга благодаря присутствию на их поверхности комплементарных по форме участков. Каждая из субъединиц или полипептидных цепей обозначается буквами, их 4 у Нв взрослого человека (Нв А), эти цепи называются альфа (a) и бета (b) . Каждая молекула Нв А содержит по две a- и по две b-цепи. Они различаются первичной структурой и длиной полипептидной цепи: a - цепи содержат по 141 аминокислотному остатку, b - цепи по 146.
Каждый из протомеров гемоглобина представляет собой природный координационный комплекс. В нем комплексообразователем служит Fe 2+ . Его координационное число равно 6. Поэтому ион железа связан с 6 лигандами. 4 лиганда являются пиррольными кольцами протопорфирина. Пятая связь затрачивается на соединение с белком глобином через аминокислоту гистидин, а 6 координационная связь используется для связывания с кислородом или другими газообразными веществами (СО2, СО).
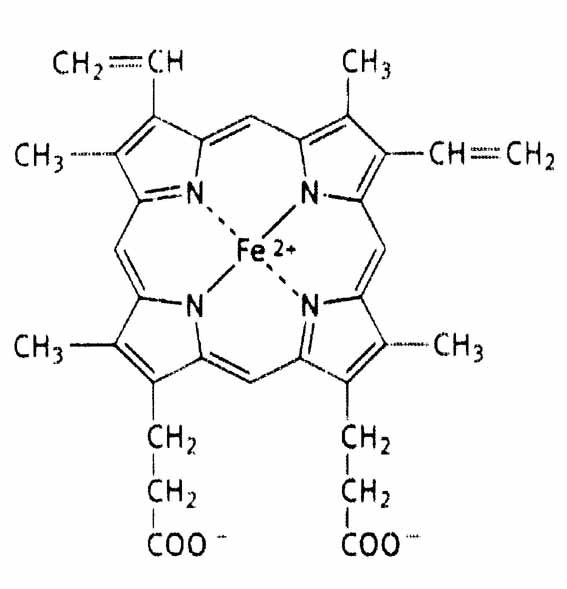
Строение гема.
Внутри каждого протомера имеется гидрофобный "карман", в котором располагается гем, способный присоединять кислород.
Схема молекулы гемоглобина.
Основная функция гемоглобина – перенос кислорода из легких к периферическим тканям. Первая молекула кислорода изменяет конформацию протомера, к которому она присоединилась. Поскольку этот протомер соединен многими связями с другими протомерами, изменяется конформация и сродство других протомеров к лигандам. Это явление называют кооперативностью изменения конформации протомеров. Изменение конформации таковы, что сродство гемоглобина ко 2-й молекуле кислорода увеличивается. В свою очередь присоединение 2-ой, а затем и 3-ей молекулы кислорода, так же изменяет конформацию и облегчает присоединение следующих молекул кислорода. Сродство гемоглобина к 4-ой молекуле кислорода примерно в 300 раз больше чем к 1-ой.
Модель молекулы гемоглобина.
Кроме кислорода, молекула гемоглобина может быть связана с другими лигандами. Например, при соединении Hb с оксидом углерода (II) (угарный газ СО), образуется карбоксигемоглобин (НвСО). Причем гемоглобин имеет большее сродство к угарному газу чем к кислороду. Поэтому если в воздухе содержится угарный газ, гемоглобин легче с ним связывается и теряет способность связывать кислород. Наступает смерть от удушья, от недостаточного снабжения тканей кислородом.
Возможно образование еще одного производного гемоглобина - карбгемоглобина, когда гемоглобин связывается с СО2 . Однако СО2 связывается не с гемом, а присоединяется к NH2 – группам глобина. Образование карбгемоглобина используется для выведения СО2 из тканей к легким. Этим путем выводится 10-15% СО2.
Типы гемоглобинов.
Гемоглобины могут различаться по белковой части. Различают физиологические и аномальные типы гемоглобинов. Физиологические типы образуются на разных этапах нормального развития организма, а аномальные - вследствие нарушения последовательности аминокислот в белке глобине физиологических типов гемоглобина.
Физиологические типы гемоглобинов отличаются друг от друга набором полипептидных цепей или субъединиц, образующихся на разных этапах развития организма человека – от эмбрионального до взрослого состояния. Различаются следующие физиологические типы гемоглобинов:
а) примитивный НвР, появляется на самых ранних стадиях развития эмбриона (1 – 2 недели) Эмбриональный гемоглобин – тетрамер
б) фетальный гемоглобин НвF (от лат. Fetus – плод). НвF является главным типом гемоглобина плода и составляет к моменту рождения 70% всего гемоглобина – это тетрамер (
в) гемоглобин взрослого НвА, НвА2, НвА3 ( от лат. Adultus – взрослый ). НвА появляется на более поздних стадиях развития плода, в крови взрослого человека примерно 95 – 96% НвА – это тетрамер (2?, 2?). Гемогловин А2 – тетрамер . Его содержание в эритроцитах взрослого человека равно 2%.
Аномальные гемоглобины. Их обнаружено более 200 и отличаются они составом цепей или заменой аминокислот в полипептидных цепях. Из аномальных гемоглобинов часто встречается HвS или серповидно-клеточный Нв. Он обнаруживается у больных серповидно-клеточной анемией. Это широко распространенное заболевание в странах Южной Америки, Африки и Юго-Восточной Азии. При этой патологии эритроциты в условиях низкого парциального давления кислорода принимают форму серпа. Гемоглобин S отличается по ряду свойств от нормального гемоглобина. После отдачи кислорода в тканях он превращается в плохо растворимую форму и начинает выпадать в осадок в виде веретенообразных кристаллоидов. Последние деформируют клетку и приводят к массивному гемолизу.
Химический дефект при серповидно-клеточной анемии сводится к замене в белке одной аминокислоты на другую. В норме в b - субъединицах тетрамерной структуры гемоглобина в шестом положении со стороны N – конца находится глутаминовая аминокислота, боковая группа которой имеет отрицательный заряд и характеризуется высокой гидрофильностью. При серповидно-клеточной анемии глутаминовая аминокислота заменена на гидрофобную аминокислоту – валин. Однако одной этой замены оказалось достаточно не только для нарушения формы эритроцита, но и для развития болезни.
Миоглобин также относится к хромопротеинам. Это белок, имеющий третичную структуру. Вторичная и третичная структура миоглобина и протомеров гемоглобина очень сходны. Функции миоглобина и гемоглобина одинаковы. Оба белка участвуют в транспорте кислорода. Гемоглобин присоединяет кислород из альвеолярного воздуха и доставляет его в ткани. Миоглобин присоединяет кислород, доставленный гемоглобином и служит промежуточным звеном в транспорте кислорода внутри клетки к митохондриям, а также для запасания кислорода в тканях, создавая кислородный резерв, который расходуется по мере необходимости. В условиях интенсивной мышечной работы, когда парциальное давление кислорода в тканях падает, кислород освобождается из комплекса с миоглобином и используется в митохондриях клеток для получения энергии, необходимой для работы мышц.
УГЛЕВОД – БЕЛКОВЫЕ КОМПЛЕКСЫ
Это комплексы белков с небелковой частью, представленной углеводными компонентами.
Смешанные макромолекулы этого типа делятся на :
ГЛИКОПРОТЕИНЫ (ГП)
ПРОТЕОГЛИКАНЫ
ГП - это сложные белки, содержащие олигосахаридные (гликановые) цепи, ковалентно связанные с белковой основой. К этой группе химических соединений относятся многие белки внешней поверхности цитоплазматических мембран и большинство секретируемых белков. ГП могут содержать до 40% углеводов, но как правило, в молекуле преобладает белковая часть.
Короткие углеводные цепи ГП построены из глюкозамина, галактозамина, глюкозы, галактозы. Наиболее значимые моносахариды в составе ГП – N – ацетилглюкозамин, N – ацетилгалактозамин, N – ацетилнейраминовая (сиаловая) кислота.
Число коротких углеводных цепей в ГП может доходить до 300-800. Длина и степень разветвленности углеводных цепей значительно варьирует. В составе одной олигосахаридной цепи находится не более 15-20 моносахаридных остатков. ГП присутствуют во всех классах белков – ферментах, гормонах, транспортных, структурных белках. Представители ГП – коллаген, эластин, иммуноглобулины.
Углеводный компонент, даже небольшой по массе, сообщает качественно новые свойства молекуле белка гликопротеинов. Для гликопротеинов характерна термостабильность, в отличие от простых белков ГП выдерживают высокие и низкие температуры без изменения физико-химических свойств. ГП в отличие от других белков с трудом перевариваются протеолитическими ферментами.
Углеводная часть придает белку большую специфичность. Это своего рода векторные группы сложных белков, «узнающие» участки других структур (макромолекул, поверхности клеток). ГП быстрее выводятся из клетки и находятся, как правило, вне клетки.
Гликопротеины выполняют следующие функции :
1. Функция избирательного взаимодействия высокоспецифического узнавания.
Клеточные ГП, находящиеся на поверхности мембран, участвуют в очень тонких процессах биологического узнавания и межклеточного взаимодействия, выполняя роль рецепторных систем для определенных соединений и клеток.
2. Транспортная роль.
ГП осуществляют транспорт гидрофобных веществ и ионов металлов. Так
функцию переносчика железа выполняет ГП – трансферрин; меди – церуллоплазмин; стероидных гормонов – транскортин.
3. Каталитическая.
Углеводный компонент обнаружен в составе некоторых ферментов: энтерокиназа, пероксидаза, глюкозооксидаза, холинэстераза.
4. Функция защитной смазки.
Гликопротеины являются составными веществами муцинов слюны, желудочного и кишечного муцинов.
5. Участвуют в процессе свертывания крови.
Протромбин, фибриноген – являются белками свертывающей системы крови.
ПРОТЕОГЛИКАНЫ.
Это углевод-белковые комплексы, углеводный компонент которых представлен гетерополисахаридами, построенными из большого числа повторяющихся единиц. В отличие от гликопротеинов, которые содержат только несколько процентов углеводов ( по массе ), протеогликаны могут содержать до 95 % и более углеводов. Кроме того, по свойствам они ближе к углеводам, чем к белкам. Белки в протеогликанах представлены одной полипептидной цепью разной молекулярной массы.
В состав протеогликанов входят кислые гетерополисахариды (гликозамингликаны) линейного строения. Они построены из повторяющихся дисахаридных единиц – димеров. Одним из компонентов этих димеров является Д-глюкуроновая кислота.
В составе притеогликанов содержатся следующие гетерополисахариды: гиалуроновая кислота, хондроитинсульфаты, гепарин (строение гетерополисахаридов смотри в разделе 3-4).
Гиалуроновая кислота состоит из повторяющихся единиц (димеров) включающих Д-глюкуроновую кислоту и N-ацетилглюкозамин.
Хондроитинсульфаты содержат структурные единицы из глюкуроновый кислоты и сульфатированного N-ацетилгалактозамина.
Протеогликаны являются обязательными компонентами межклеточного матрикса, играют важную роль в межклеточных взаимодействиях, формировании и поддержании формы клеток и органов, образовании каркаса при формировании тканей.
Благодаря особенностям структуры и физико-химическим свойствам протеогликаны выполняют в организме следующие функции:
- являются структурными компонентами межклеточного матрикса;
- являясь поликатионами они могут присоединять, кроме воды большие количества катионов (Na+, K+, Ca2+) и таким образом участвовать в формировании тургора различных тканей;
- протеогликаны играют роль молекулярного сита в межклеточном матриксе и препятствуют распространению патогенных микроорганизмов.
Эта группа полисахаридов представляет собой сильно гидратированные, желеподобные, липкие вещества, имеющие значительный отрицательный заряд. Все они находятся в межклеточном веществе, но не в свободном состоянии, а связаны с белками. Такие смешанные макромолекулы называются протеогликанами, поскольку основные свойства этих макромолекул определяются углеводной, а не белковой частью.
ЛИПИД – БЕЛКОВЫЕ КОМПЛЕКСЫ
Это комплексы белков с липидными компонентами, их условно подразделяют на две группы:
