
- •Биохимия
- •1.1. Белки. Аминокислоты -- структурные компоненты белков
- •Аминокислоты, содержащие неполярные r-группы.
- •Аминокислоты, содержащие полярные, неионные r-группы.
- •Аминокислоты с полярными отрицательно заряженными
- •Аминокислоты с полярными положительно заряженными r-группами.
- •1.3. Уровни структурной организации белковых молекул
- •1.4. Физико-химические свойства белков
- •1.5. Классификация белков
- •Характеристика простых белков.
- •1.6.1. Хромопротеины
- •1. Свободные липопротеины.
- •2. Структурные протеолипиды.
- •1.Свободные липопротеины.
- •2.Структурные липопротеины ( протеолипиды ).
- •Нуклеопротеины
- •1.6. Углеводы. Классификация углеводов
- •2.2. Моносахариды
- •2.3. Олигосахариды
- •2.4. Гомополисахариды (пс).
- •2.5. Гетерополисахариды
- •1.7. Липиды Липиды
- •4.1. Жирные кислоты и ацилглицеролы.
- •4.2. Фосфолипиды и сфинголипиды
- •4.2.1.Фосфолипиды
- •1.8.1. Жирорастворимые витамины
- •1.8.2. Водорастворимые витамины
- •1.8.3. Витаминоподобные вещества.
- •1.8. Витамины
- •Рацион взрослого человека
- •1.8.1. Жирорастворимые витамины
- •1.8.2. Водорастворимые витамины
- •1.8.3. Витаминоподобные вещества.
- •2.1. Ферменты и неорганические катализаторы
- •2.2. Строение ферментов
- •2.3. Коферменты
- •2.4. Свойства ферментов
- •2.5. Номенклатура ферментов
- •2.6. Классификация ферментов
- •2.7. Механизм действия ферментов
- •Это снижение каталитической активности в присутствии определенных веществ – ингибиторов.
- •1.Обратимые - это соединения, которые нековалентно взаимодействуют с ферментом, при этом образуется комплекс, способный к диссоциации.
- •3. Обмен углеводов
- •3.1. Биологическая роль углеводов
- •3.2. Превращение углеводов в пищеварительном тракте
- •3.3. Биосинтез и распад гликогена
- •3.4.1. Анаэробный гликолиз
- •3.4.2. Аэробный гликолиз (гексозодифосфатный путь)
- •3.4.2. Аэробный гликолиз (гексозодифосфатный путь)
- •3.4.3. Гексозомонофосфатный путь
- •3.4.4. Глюконеогенез
- •3. Глюконеогенез.
- •4.1. Основные липиды организма человека их биологическая роль.
- •4.2. Переваривание липидов, ресинтез жира
- •4.3. Липопротеины крови
- •4.4. Окисление высших жирных кислот
- •4.5. Окисление глицерина
- •4.6. Биосинтез вжк в тканях
- •4.7. Обмен холестерина
- •5.1. Переваривание белков
- •5.2. Гниение аминокислот, обезвреживание продуктов гниения
- •5.3. Метаболизм аминокислот
- •5.4. Пути обезвреживания аммиака
- •6. Регуляция обмена веществ
- •6.1. Сигнальные молекулы
- •6.2. Гормоны гипоталамуса
- •6.3. Гормоны гипофиза
- •6.3. Гормоны гипофиза
- •6.4. Гормоны щитовидной железы гормоны щитовидной железы
- •6.5. Гормоны паращитовидных желез гормоны паращитовидных желез
- •6.6. Гормоны половых желез
- •6.7. Гормоны надпочечников
- •6.8. Гормоны поджелудочной железы
- •7. Экзаменационные вопросы
Аминокислоты, содержащие неполярные r-группы.
В боковой цепи этих аминокислот содержатся неполярные, неионные группы. К данному классу относятся алифатические аминокислоты. Глицин это самая маленькая аминокислота, содержащая в боковой цепи атом водорода, поэтому в белке её остаток не имеет ярко выраженных гидрофобных или гидрофильных свойств. Аминокислоты аланин, валин, лейцин, изолейцин - алифатические неполярные аминокислоты. По мере увеличения боковой цепи увеличивается их гидрофобность. К этой группе относятся также аминокислоты триптофан, фенилаланин, метионин и иминокислота - пролин
Аминокислоты, содержащие полярные, неионные r-группы.
Аминокислоты этой группы содержат в боковой цепи неионогенные группы, не способные отдавать или присоединять протон. Боковые группы этих аминокислот растворяются в воде т.к. в их состав входят полярные функциональные группы, образующие водородные связи с водой. К ним относятся серин, треонин, содержащие в боковой цепи спиртовой гидроксил, а также глутамин, аспарагин, содержащие амидные группы. К этой же группе относятся цистеин и тирозин. Эти аминокислоты содержат соответственно тиольную группу и фенольный гидроксил, способные к диссоциации, но при нейтральных значениях рН, поддерживаемых в клетках, эти группы практически не диссоциируют.
Аминокислоты с полярными отрицательно заряженными
R- группами.
К этой группе относят аспарагиновую и глутаминовую аминокислоты, имеющие в боковой цепи дополнительную карбоксильную группу, способную к диссоциации.
Следовательно, боковые группы данных аминокислот – анионы. Ионизированные формы глутаминовой и аспарагиновой кислот называют соответственно глутаматом и аспартатом.
Аминокислоты с полярными положительно заряженными r-группами.
Дополнительную положительно заряженную группу в боковой цепи имеют лизин, аргинин. Кроме того гистидин содержит слабо ионизированную имидазольную группу, поэтому при физиологических колебаниях значений рН (от 6,9 до 7,4) гистидин заряжен либо нейтрально, либо положительно. При увеличении количества протонов в среде имидазольная группа гистидина способна присоединять протон, приобретая положительный заряд, а при увеличении концентрации гидроксильных групп – отдавать протон теряя положительный заряд.
Предыдущий раздел |
Раздел верхнего уровня |
Следующий раздел |
1.3. Уровни структурной организации белковых молекул
Пептидные цепи содержат десятки, сотни и тысячи аминокислотных остатков, соединенных прочными пептидными связями. За счет внутримолекулярных взаимодействий белки образуют определенную пространственную структуру, называемую "конформация “белков.
Структура белковых молекул отличается значительной сложностью и своеобразной организацией. Различают 4 уровня структурной организации белка: первичную, вторичную, третичную и четвертичную.
Первичная структура – это последовательность аминокислот в полипептидной цепи, соединенных пептидными связями. К настоящему времени полностью расшифрована первичная структура многих белков: инсулина, гемоглобина, миоглобина, трипсиногена, лизоцима и др. Установлены не только межвидовые, но и выявляются индивидуальные особенности первичной структуры отдельных белков.
Последовательность аминокислот в полипептидной цепи определяет последующие уровни структурной организации белка, его важнейшие физико-химические, биологические свойства и является уникальной в каждом отдельном случае (закрепленной генетически).
Вторичная структура – это конфигурация полипептидной цепи в пространстве, образующаяся в результате взаимодействий между функциональными группами, входящими в состав пептидного остова.
Вторичная структура белков (a-спираль). Полипептидная цепь образует спираль вращением вокруг воображаемого цилиндра.
Вид с торца a-спирали – проекции боковых групп ориентированы произвольно.
Отдельные участки полипептидной цепи существуют в виде a -спирали, бета- структуры (складчатого листа), нерегулярные вторичные структуры (кольца, изгибы, петли).
Вторичная структура характеризует организацию полипептидного скелета. Внешне альфа-спираль похожа на слегка растянутую спираль телефонного шнура. Термин “альфа-спираль” предложил Л. Полинг, открывший такую укладку в кератине. На один виток спирали в среднем приходится 3,6 аминокислотных остатка, а шаг спирали составляет 0,54 нм. альфаспираль стабилизируется (т.е. удерживается) с помощью большого количества водородных связей, которые образуются между атомами водорода и атомами более электоотрицательного кислорода - атомов, входящих в состав пептидных групп.
Это означает, что группа >С=О одной пептидной связи образует водородную связь с группой -N-Н другой пептидной связи, отстающей от первой на четыре аминокислотных остатка. Водородные связи между >С=О и - N-H направлены параллельно оси спирали.
Водородные связи как бы сшивают спираль, удерживая полипептидную цепь в закрученном состоянии. Некоторые аминокислоты в силу строения их боковых групп препятствуют спирализации цепи. Например, пролин или оксипролин не содержат атома водорода в пептидной группе и, следовательно, не могут образовывать водородные связи. Поэтому участки полипептидной цепи, где есть пролин или оксипролин не способны к спирализации и полипептидная цепь делает изгиб “шпильку”.
Структура бета - складчатого листа. Эта структура напоминает меха аккордеона.
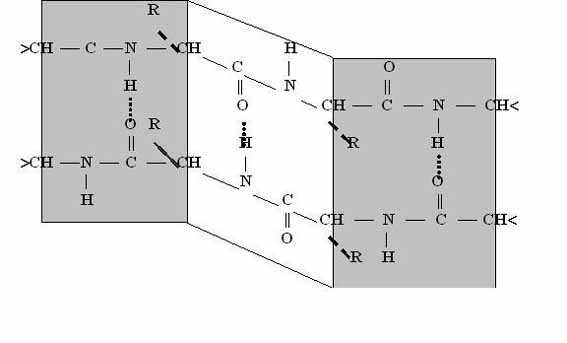
Структура складчатого листа
бета – структура формируется между линейными участками одной полипептидной цепи, образуя при этом складки или между разными полипептидными цепями. Полипептидые цепи или их части могут формировать параллельные и антипараллельные альфа-структуры.
Структура складчатого листа характерна для фибриллярных белков (нитевидных).
Соединительные петли - это участки полипептидной цепи, которые по конформации нельзя отнести ни к a-спирали, ни к b-складчатому листу. В соединительных петлях не все пептидные группы участвуют в образовании водородных связей и такие участки чаще находятся на поверхности белковой глобулы, в области ее контакта с водой.
Во многих белках одновременно имеются a-спиральные участки, b-структуры и соединительные петли. Природных белков, состоящих на 100% из a-спирали практически нет. Белки имеют неодинаковую степень спирализации. Высокая степень альфа-спирализации характерна для белков миоглобина, гемоглобина.
Напротив, белки опорных тканей кератин , коллаген (белок сухожилий, кожи) имеют в основном b-структуру.
Определенные сочетания альфа-спиралей и бета-структур в некоторых белках называют супервторичной структурой белков. Они имеют специфические названия: структура «бета-бочонка», «цинковый палец» и др.
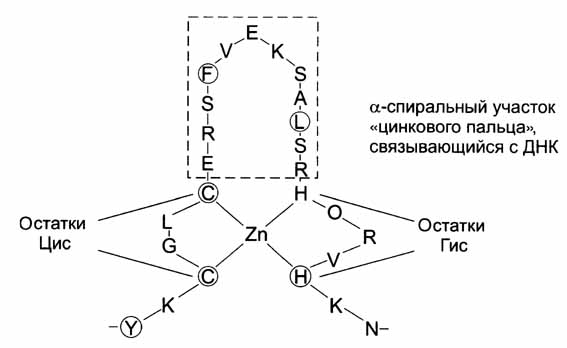
Фрагмент ДНК-связывающего белка в форме «цинкового пальца»
«Цинковый палец» - фрагмент белка, содержащий около 20 аминокислотных остатков, в котором атом цинка связан с боковыми группами 4 аминокислот: с двумя остатками цистеина и двумя гистидина. Два близко лежащих остатка цистеина отделены от 2 других остатков гистидина аминокислотной последовательностью состоящей из 12 аминокислотных остатков. Этот участок белка образует ? – спираль, которая может специфически связываться с регуляторными участками ДНК.
Третичная структура - это способ укладки полипептидной цепи в пространстве в виде компактной упаковки, за счет связей между радикалами. Эти взаимодействия могут возникать между группами, расположенными на значительном расстоянии друг от друга и полипептидная цепь, многократно изгибаясь, складываясь, образует глобулы или фибриллы, В поддержании третичной структуры важную роль играют слабые, но многочисленные водородные связи, ионные и гидрофобные взаимодействия, а также сильные дисульфидные связи.
а) Дисульфидные связи возникают между молекулами цистеина, расположенными на различных участках полипептидной цепи (идет окислительно-восстановительный процесс).
б) Ионные взаимодействия возможны между различными участками полипептидной цепи, имеющими разноименно заряженные группы. Этот вид взаимодействия возможен между моноаминодикарбоновыми кислотами (асп, глу), боковые цепи которых имеют отрицательный заряд и диаминомонокарбоновыми аминокислотами (лизин, аргинин), боковые цепи которых имеют положительный заряд.
в) Гидрофобные взаимодействия
Полипептидная цепь укладывается таким образом, что гидрофильные боковые группы (R- группы) аминокислот обращены наружу, а гидрофобные располагаются внутри. Гидрофобные группировки, испытывая отвращение к воде, стремясь избежать соприкосновения с ней, теснее сближаются друг с другом и взаимодействуют между собой.
Третичная структура - уникальное для каждого белка расположение в пространстве полипептидной цепи, зависящее от количества и чередования аминокислот, т.е. предопределенное первичной структурой. Благодаря наличию третичной структуры определяется форма белковой молекулы, характерная для каждого белка и необходимая для проявления его специфических, биологических свойств.
По форме белковых молекул белки бывают двух типов: фибриллярные (нитевидные) полипептидные цепи, они расположены параллельно друг другу, глобулярные, в которых полипептидные цепи плотно свернуты и образуют компактные структуры округлой формы - глобулы.
Примером фибриллярных белков являются белки соединительных тканей коллаген, эластин. Типичными глобулярными белками являются гемоглобин, миоглобин. Некоторые белки могут существовать как в глобулярной, так и в фибриллярной форме. Например, сократительный белок мышц актин.
Характерным глобулярным белком является миоглобин, содержащийся в мышцах. В молекуле миоглобина имеется одна полипептидная цепь, состоящая из 153 аминокислотных остатков и ядра гема. Эта полипептидная цепь очень компактно упаковывается, образуя глобулу. Основная функция миоглобина - связывание кислорода, в отличие от гемоглобина он в 5 раз быстрее связывает кислород. В этом кроется большой биологический смысл, поскольку миоглобин находится в глубине мышечной ткани (где низкое парциальное давление кислорода). Жадно связывая кислород, миоглобин создает кислородный резерв, который расходуется по мере необходимости, восполняя временный недостаток кислорода.
Типы связей, участвующих в стабилизации третичной структуры.
Белковые модули (домены)
Обычно белки, образованные одной полипептидной цепью, представляют собой компактное образование, каждая часть которого не может функционировать и существовать отдельно, сохраняя прежнюю структуру. Однако, в некоторых случаях, при большом содержании аминокислотных остатков (более 200), в трехмерной структуре обнаруживается не одна, а несколько независимых компактных областей одной полипептидной цепи. Эти фрагменты полипептидной цепи, сходные по свойствам с самостоятельными глобулярными белками, называются модулями или доменами. Например, в дегидрогеназах два домена, один связывает НАД+ и этот домен сходен по строению у всех НАД-зависимых дегидрогеназ, а другой домен связывает субстрат и отличается по структуре у разных дегидрогеназ.
Синтаза жирных кислот, представляющая одну полипептидную цепь, имеет 7 доменов, для катализа 7 реакций. Предполагается, что домены синтазы некогда объединились в один белок в результате слияния генов. Соединение модулей (доменов) в один белок способствует быстрому появлению и эволюции новых функциональных белков.
Активный центр белка и взаимодействие его с лигандом.
Активный центр белка – это центр связывания белка с лигандом. На поверхности глобулы образуется участок, который может присоединять к себе другие молекулы называемые лигандами. Активный центр белка формируется из боковых групп аминокислот, сближенных на уровне третичной структуры. В линейной последовательности пептидной цепи они могут находиться на расстоянии значительно удаленном друг от друга. Белки проявляют высокую специфичность при взаимодействии с лигандом. Высокая специфичность взаимодействия белка с лигандом обеспечивается комплементарностью структуры активного центра белка структуре лиганда. Комплементарность – это пространственное и химическое соответствие взаимодействующих молекул. Центры связывания белка с лигандом часто располагаются между доменами (например, центр связывания трипсина с его лигандом имеет 2 домена разделенных бороздкой).
В основе функционирования белков лежит их специфическое взаимодействие с лигандами. 50000 индивидуальных белков, содержащих уникальные активные центры, способные связываться только со специфическими лигандами и, благодаря особенностям строения активного центра, проявлять свойственные им функции. Очевидно, в первичной структуре содержится информация о функции белков.
Четвертичная структура - это высший уровень структурной организации, возможный не у всех белков. Под четвертичной структурой понимают способ укладки в пространстве полипептидных цепей и формирование единого в структурном и функциональном отношениях макромолекулярного образования. Каждая отдельно взятая полипептидная цепь, получившая название протомера или субъединицы, чаще всего не обладает биологической активностью. Эту способность белок приобретает при определенном способе пространственного объединения входящих в его состав протомеров. Образовавшуюся молекулу принято называть олигомером (мультимером).
Четвертичную структуру стабилизируют нековалентные связи, которые возникают между контактными площадками протомеров, которые взаимодействуют друг с другом по типу комплементарности.
К белкам, имеющим четвертичную структуру, относятся многие ферменты (лактатдегидрогеназа, глутаматдегидрогеназа и др.), а также гемоглобин, сократительный белок мышц миозин. Одни белки имеют небольшое число субъединиц 2 – 8, другие сотни и даже тысячи субъединиц. Например, белок вируса табачной мозайки имеет 2130 субъединиц.
Типичным примером белка, имеющего четвертичную структуру, является гемоглобин. Молекула гемоглобина состоит из 4 субъединиц, т. е. полипептидных цепей, каждая из которых связана с гемом, из них 2 полипептидные цепи называются -2афьла и -2бета Они различаются первичной структурой и длиной полипептидной цепи.
Связи, образующие четвертичную структуру менее прочные. Под влиянием некоторых агентов происходит разделение белка на отдельные субъединицы. При удалении агента субъединицы могут вновь объединиться и биологическая функция белка восстанавливается. Так при добавлении к раствору гемоглобина мочевины он распадается на 4 составляющие его субъединицы, при удалении мочевины структурная и функциональная роль гемоглобина восстанавливается.
Предыдущий раздел |
Раздел верхнего уровня |
Следующий раздел |
