
- •Биохимия
- •1.1. Белки. Аминокислоты -- структурные компоненты белков
- •Аминокислоты, содержащие неполярные r-группы.
- •Аминокислоты, содержащие полярные, неионные r-группы.
- •Аминокислоты с полярными отрицательно заряженными
- •Аминокислоты с полярными положительно заряженными r-группами.
- •1.3. Уровни структурной организации белковых молекул
- •1.4. Физико-химические свойства белков
- •1.5. Классификация белков
- •Характеристика простых белков.
- •1.6.1. Хромопротеины
- •1. Свободные липопротеины.
- •2. Структурные протеолипиды.
- •1.Свободные липопротеины.
- •2.Структурные липопротеины ( протеолипиды ).
- •Нуклеопротеины
- •1.6. Углеводы. Классификация углеводов
- •2.2. Моносахариды
- •2.3. Олигосахариды
- •2.4. Гомополисахариды (пс).
- •2.5. Гетерополисахариды
- •1.7. Липиды Липиды
- •4.1. Жирные кислоты и ацилглицеролы.
- •4.2. Фосфолипиды и сфинголипиды
- •4.2.1.Фосфолипиды
- •1.8.1. Жирорастворимые витамины
- •1.8.2. Водорастворимые витамины
- •1.8.3. Витаминоподобные вещества.
- •1.8. Витамины
- •Рацион взрослого человека
- •1.8.1. Жирорастворимые витамины
- •1.8.2. Водорастворимые витамины
- •1.8.3. Витаминоподобные вещества.
- •2.1. Ферменты и неорганические катализаторы
- •2.2. Строение ферментов
- •2.3. Коферменты
- •2.4. Свойства ферментов
- •2.5. Номенклатура ферментов
- •2.6. Классификация ферментов
- •2.7. Механизм действия ферментов
- •Это снижение каталитической активности в присутствии определенных веществ – ингибиторов.
- •1.Обратимые - это соединения, которые нековалентно взаимодействуют с ферментом, при этом образуется комплекс, способный к диссоциации.
- •3. Обмен углеводов
- •3.1. Биологическая роль углеводов
- •3.2. Превращение углеводов в пищеварительном тракте
- •3.3. Биосинтез и распад гликогена
- •3.4.1. Анаэробный гликолиз
- •3.4.2. Аэробный гликолиз (гексозодифосфатный путь)
- •3.4.2. Аэробный гликолиз (гексозодифосфатный путь)
- •3.4.3. Гексозомонофосфатный путь
- •3.4.4. Глюконеогенез
- •3. Глюконеогенез.
- •4.1. Основные липиды организма человека их биологическая роль.
- •4.2. Переваривание липидов, ресинтез жира
- •4.3. Липопротеины крови
- •4.4. Окисление высших жирных кислот
- •4.5. Окисление глицерина
- •4.6. Биосинтез вжк в тканях
- •4.7. Обмен холестерина
- •5.1. Переваривание белков
- •5.2. Гниение аминокислот, обезвреживание продуктов гниения
- •5.3. Метаболизм аминокислот
- •5.4. Пути обезвреживания аммиака
- •6. Регуляция обмена веществ
- •6.1. Сигнальные молекулы
- •6.2. Гормоны гипоталамуса
- •6.3. Гормоны гипофиза
- •6.3. Гормоны гипофиза
- •6.4. Гормоны щитовидной железы гормоны щитовидной железы
- •6.5. Гормоны паращитовидных желез гормоны паращитовидных желез
- •6.6. Гормоны половых желез
- •6.7. Гормоны надпочечников
- •6.8. Гормоны поджелудочной железы
- •7. Экзаменационные вопросы
2.3. Коферменты
КОФЕРМЕНТЫ
Коферменты – небелковая часть сложных ферментов. Их делят на две группы:
1.Витаминные.
2.Невитаминные.
Витаминные коферменты:
1.Тиаминовые коферменты содержат в своём составе витамин В1 (тиамин).
– ТДФ – тиаминдифосфат;
ТДФ связан с ферментами - декарбоксилазами альфа – кетокислот (входит в состав пируватдегидрогеназного и альфа-кетоглутаратдегидрогеназного комплексов);
Является коферментом трансктолаз.
2.Флавиновые коферменты содержат в своём составе витамин В 2.
– ФМН – флавинмононуклеотид;
– ФАД - флавинадениндинуклеотид.
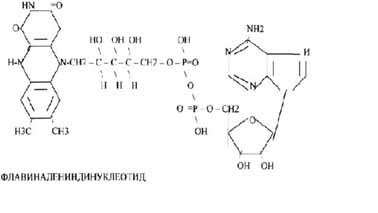
ФМН и ФАД связаны с ферментами дегидрогеназами. Участвуют в реакциях дегидрирования.
3. Пантотеновые коферменты содержат в своём составе витамин ВЗ (пантотеновая кислота).
Представитель – кофермент А.
Участвует в :
Переносе ацильных радикалов;
Активации жирных кислот;
Синтезе холестерола и кетоновых тел;
Обезвреживании ксенобиотиков.
4. Никотинамидные коферменты содержат в своём составе витамин РР (никотинамид).
– НАД (никотинамидадениндинуклеотид);
– НАДФ (никотинамидадениндинуклеотидфосфат).
Кофермент могут быть в окисленной и восстановленной форме.
НАД и НАДФ связаны с ферментами дегидрогеназами, которые ускоряют окислительно-восстановительные реакции.

5. Пиридоксиновые коферменты содержат в своём составе витамин В6.
Кофермент – пиридоксальфосфат (ПФ).
Участвует в реакциях превращения АК:
1.Реакции переаминирования (трансаминирование). Связан с ферментами аминотрансферазами.
2.Реакции декарбоксилирования аминокислот.
НЕВИТАМИНЫЕ КОФЕРМЕНТЫ
Не содержат в своём составе витаминов, но участвуют в каталитических превращениях.
1. Нуклеотиды: АТФ, ЦТФ (участвуют в синтезе фосфолипидов); УДФ, УТФ, ГТФ (участвуют в синтезе гликогена).
2. Производные порфирина: гем, цитохромы, каталаза.
3. Пептиды:
Глутатион - трипептид, содержащий ГЛУ-ЦИС-ГЛИ. Он связан с ферментами оксидоредуктазами. Участвует в окислительно-восстановительных реакциях.
Предыдущий раздел |
Раздел верхнего уровня |
Следующий раздел |
2.4. Свойства ферментов
СВОЙСТВА ФЕРМЕНТОВ.
1 .Высокая каталитическая активность.
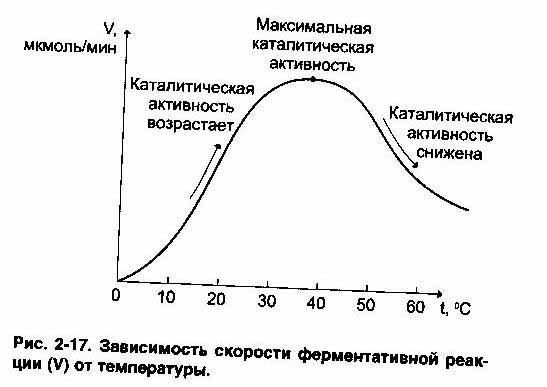
2.Ферменты, являясь белками, проявляют термолабильные свойства - чувствительность к изменению температуры.
При повышении температуры на каждые 10 градусов Цельсия, скорость ферментативных реакций повышает в 1,5 - 2 раза (правило Вант - Гоффа). Это правило применимо для ферментов в очень узком интервале температуры, т.к. уже при 50-60 градусах наблюдается денатурация, а при 100 градусов Цельсия - полная денатурация с потерей активности. При 1-3 градусов Цельсия Активность фермента также понижается, но при понижении температуры структура его сохраняется, поэтому при последующем повышении температуры активность восстанавливается. Это свойство используется в клинической практике при проведении оперативных вмешательств. Температура, при которой фермент проявляет максимальную активность, называется оптимальной.
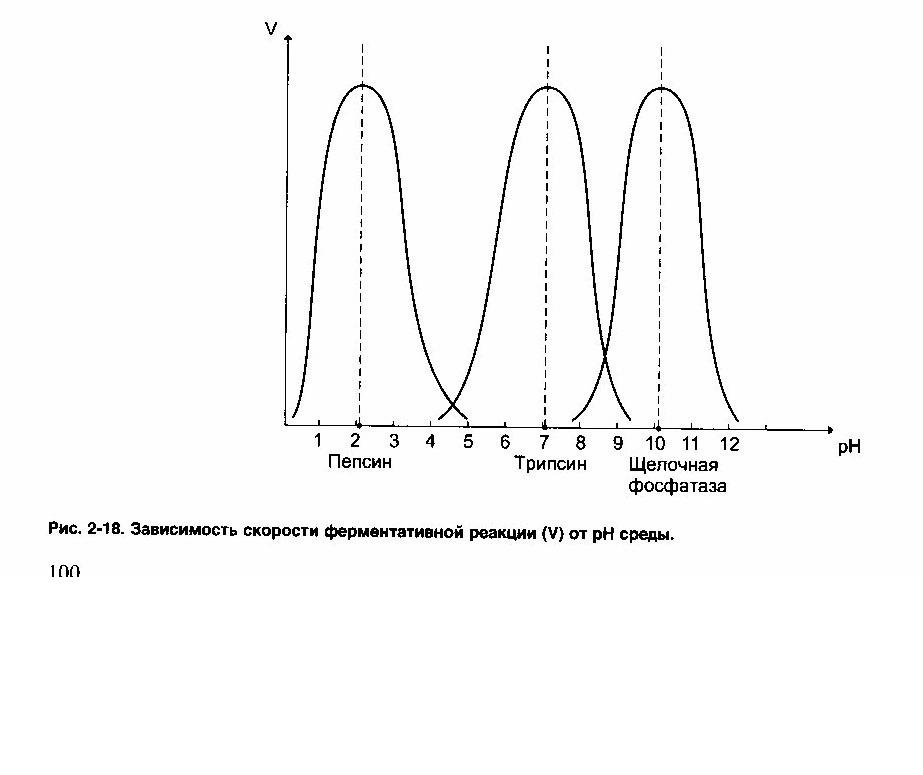
3.Ферменты чувствительны к изменениям рН среды. Для большинства ферментов оптимальные значения РН лежат в нейтральной среде (для каталазы рН = 7).
Есть ферменты, для которых оптимальные значения рН лежат в кислой среде (пепсин рН = 1 ,5-2,5). Некоторые ферменты проявляют активность в щелочной среде (аргиназа рН = 10 - 11). Изменения рН приводит к изменению степени ионизации кислых и основных групп в активном центре фермента, т.к. эти группы участвуют в связывании субстрата и его превращении. Изменение рН приводит к конформационной перестройке не только активного центра фермента, но и всей молекулы фермента. Это может сопровождаться нарушением третичной структуры фермента. При оптимальном значении рН функциональные группы активного центра находятся в наиболее реакционно-способном состоянии, и это обеспечивает образование фермент-субстратного комплекса.
Специфичность действия ферментов.
Субстратная специфичность
1. Абсолютная специфичность. Ей обладают ферменты, которые действуют только на 1 субстрат и не действуют на другие субстраты.
Уреаза катализирует гидролиз мочевины.
Аргиназа расщепляет аргинин.
Фумараза ускоряет гидратацию фумаровой кислоты.
2. Стереоспецифичность. Ей обладают ферменты, действующие на пространственные или стереоизомеры. Цис- и транс- изомеры; оптические изомеры.
3. Групповая специфичность. Ей обладают ферменты, которые катализируют однотипные реакции сходных по строению субстратов, т.е. эти субстраты могут содержать в своём составе одинаковые группы атомов.
Изоферменты
Ферменты, катализирующие одну и ту же химическую реакцию, но отличающиеся по первичной структуре белка, называют изофермен-тами, или изоэнзимами. Они катализируют один и тот же тип реакции с принципиально одинаковым механизмом, но отличаются друг от друга кинетическими параметрами, условиями активации, особенностями связи апофермента и кофермента.
Природа появления изоферментов разнообразна, но чаще всего обусловлена различиями в структуре генов, кодирующих эти изоферменты. Следовательно, изоферменты различаются по первичной структуре белковой молекулы и, соответственно, по физико-химическим свойствам. На различиях в физико-химических свойствах основаны методы определения изоферментов.
По своей структуре изоферменты в основном являются олигомерными белками. Причём та или иная ткань преимущественно синтезирует определённые виды протомеров. В результате определённой комбинации этих протомеров формируются ферменты с различной структурой - изомерные формы. Обнаружение определённых изоферментных форм ферментов позволяет использовать их для диагностики заболеваний.
Изоформы лактатдегидрогеназы. Фермент лак-татдегидрогеназа (ЛДГ) катализирует обратимую реакцию окисления лактата (молочной кислоты) до пирувата (пировиноградной кислоты) (см. раздел 7).
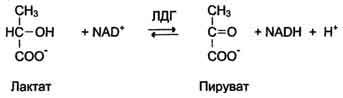
Лактатдегидрогеназа - олигомерный белок с молекулярной массой 134 000 Д, состоящий из 4 субъединиц 2 типов: М (от англ, muscle - мышца) и Н (от англ, heart - сердце). Комбинация этих субъединиц лежит в основе формирования 5 изоформ лактатдегидрогеназы (рис. 2-35, А). ЛДГ1 и ЛДГ2 наиболее активны в сердечной мышце и почках, ЛДГ4 и ЛДГ5 - в скелетных мышцах и печени. В остальных тканях имеются различные формы этого фермента.
Изоформы ЛДГ отличаются электрофоретической подвижностью, что позволяет устанавливать тканевую принадлежность изоформ ЛДГ (рис. 2-35, Б).
120
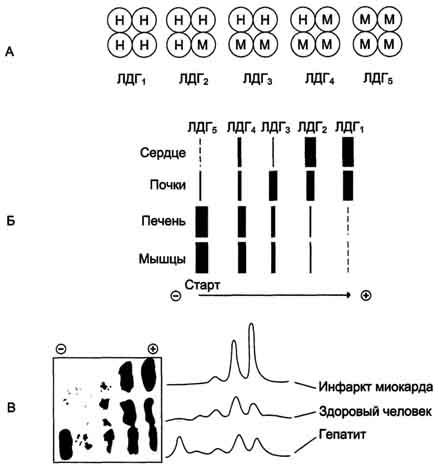
Рис. 2-35. Изоформы лактатдегидрогеназы. А - строение различных изоформ ЛДГ; Б - распределение на электрофореграмме и относительные количества изоформ ЛДГ в различных органах; В - содержание изоформ ЛДГ в плазме крови в норме и при патологии (электрофореграммы - слева и фотометрическое сканирование - справа).
Появление в эволюции различных изоформ ЛДГ обусловлено особенностями окислительного метаболизма тканей. Изоферменты ЛДГ4 и ЛДГ5 (М-типы ЛДГ) работают эффективно в анаэробных условиях, ЛДГ, и ЛДГ2 (Н-типы) - в аэробных, когда пируват быстро окисляется до СО2 и Н2О, а не восстанавливается до молочной кислоты.
При ряде заболеваний исследуют активность ЛДГ в плазме крови. В норме активность ЛДГ составляет 170-520 ЕД/л. Повышение активности наблюдают при острых поражениях сердца, печени, почек, а также при мегалобластных и гемолитических анемиях. Однако это указывает на повреждение лишь одной из перечисленных тканей.
Для постановки диагноза необходимо исследование изоформ ЛДГ в плазме крови методом электрофореза. На рис. 2-35, В представлены электрофореграммы плазмы крови здорового человека, больного инфарктом миокарда и больного гепатитом. Выявление в плазме крови тканеспецифичес-ких изоформ ЛДГ используют в качестве диагностического теста повреждения данной ткани.
Изоформы креатинкиназы. Креатинкиназа (КК) катализирует реакцию образования креатинфосфата:
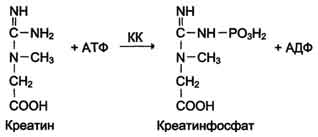
121
Молекула КК - димер, состоящий из субъединиц двух типов: М (от англ, muscle - мышца) и В (от англ, brain - мозг). Из этих субъединиц образуются 3 изофермента - ВВ, MB, MM. Изофермент ВВ находится преимущественно в головном мозге, ММ - в скелетных мышцах и MB - в сердечной мышце. Изоформы КК имеют разную электрофоретическую подвижность (рис. 2-36).
Активность КК в норме не должна превышать 90 МЕ/л. Определение активности КК в плазме крови имеет диагностическое значение при инфаркте миокарда (происходит повышение уровня МВ-изоформы). Количество изоформы ММ может повышаться при травмах и повреждениях скелетных мышц. Изоформа ВВ не может проникнуть через гематоэнцефалический барьер, поэтому в крови практически не определяется даже при инсультах и диагностического значения не имеет.
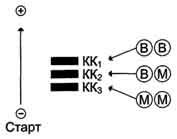
Рис. 2-36. Структура и электрофоретическая подвижность различных изоформ креатинкиназы.
Предыдущий раздел |
Раздел верхнего уровня |
Следующий раздел |
