
- •Часть 1
- •1. Современная теория строения атома. Структура периодической
- •3. Кинетика физико-химических процессов, химическое равновесие.
- •1. Закон эквивалентов. Определение эквивалентных масс
- •2. Строение атома. Квантовые числа.
- •3. Периодическая система элементов д.И. Менделеева
- •4. Химическая связь и строение молекул
- •5. Скорость химических реакций.
- •6. Химическое равновесие
- •7. Растворы. Способы выражения концентраций растворов
- •8. Электролиты . Определение концентрации ионов
- •9. Ионное произведение воды. Водородный показатель (рН)
- •10. Реакции обмена и гидролиза в растворах электролитов
- •11. Окислительно–восстановительные реакции
- •12. Комплексные соединения
- •Часть II
- •1. Основы химической термодинамики. Энергетика физико-химических
- •2. Фазовые равновесия. Физико-химический анализ. Диаграммы со-
- •13. Первый закон термодинамики . Тепловые эффекты
- •1. Закон Лавуазье-Лапласа — теплота образования сложного вещества
- •2. Закон Гесса — тепловой эффект процесса не зависит от пути его про-
- •14. Второй закон термодинамики .
- •15. Изобарно - изотермический потенциал или свободная
- •16. Фазовые равновесия . Диаграммы состояния
- •17. Гальванические элементы
- •18. Процессы электролиза
- •19. Электрохимическая коррозия металлов
- •20. Применение электрохимических процессов в технике
- •21. Химия конструкционных материалов
16. Фазовые равновесия . Диаграммы состояния
двухкомпонентных ( бинарных ) систем
Равновесие в системе, состоящей из двух или нескольких фаз, называется ге-
терогенным, или фазовым. Вещества, которые могут быть выделены из систе-
25
мы и существовать самостоятельно вне нее, называются компонентами, или со-
ставляющими. Если в равновесной системе отсутствует химическое взаимодей-
ствие между составляющими, то число компонентов равно числу составляющих,
а если в равновесной системе протекают химические реакции, то число компо-
нентов равно числу составляющих, минус число уравнений реакций взаимодей-
ствия, связывающих их концентрации при равновесии.
Наименьшее число составляющих веществ, через которое выражается состав
любой фазы, называется независимыми компонентами.
Взаимосвязь между числом независимых компонентов (К), числом фаз (Ф) и
числом внешних параметров (n), определяющих фазовое соотношение в системе,
устанавливается правилом фаз Гиббса:
С К Ф= − + n ,
(16.1)
где С — число степеней свободы (вариантность) системы, т.е. число тех пе-
ременных (температура, давление, концентрация), которые можно
изменять произвольно в определенных пределах без изменения ко-
личества и вида фаз.
Выражение (16.1) выражает основной закон фазового равновесия.
Число степеней свободы всегда величина положительная (С≥0). Максималь-
ное число фаз, находящихся в равновесии при данных условиях, определяется
минимальным числом степеней свободы (С = 0).
По числу компонентов (фаз) системы бывают одно-, двух-, трехкомпонент-
ные (трехфазные) и т.д.; Состояние системы при С = 0 называется инвариант-
ным, при С = 1 — моно- или одновариантным, при С = 2 — ди- или двухвари-
антным и т.д.
Характер взаимодействия между компонентами в гетерогенной системе, хи-
мический состав и границы существования фаз можно изучать с помощью ком-
плексного физико-химического анализа, основной целью которого является ус-
тановление функциональной зависимости свойств вещества от его химического
и фазового состава. Как правило, такие зависимости изображают графически в
виде диаграмм состояния. Для двухкомпонентной системы по оси абсцисс от-
кладывают состав, по оси ординат — свойство.
По характеру взаимодействия компонентов различают три основных вида
диаграмм состояния:
1. Диаграмма состояния с простой эвтектикой — компоненты различают-
ся по структуре и свойствам, в твердом состоянии образуют механическую
смесь, состоящую из кристаллов обоих компонентов (Сu – Ag, Au – Si).
2. Диаграмма состояния с образованием твердых растворов неограни-
ченной и ограниченной растворимости компонентов друг в друге. Если ком-
26
поненты близки по свойствам, величине атомных радиусов, имеют одинаковый
тип кристаллической решетки и при охлаждении образуют твердые растворы за-
мещения, — диаграмма состояния с неограниченной растворимостью (Au –
Ag, Ge – Si и др.). Если хотя бы одно из вышеуказанных условий не выполняет-
ся, тогда образуются твердые растворы с ограниченной растворимостью одного
компонента в другом — диаграмма состояния с ограниченной растворимо-
стью (Pb – Sn, Co – Ni и др.).
3. Диаграмма состояния с образованием химических соединений — ком-
поненты резко отличаются по свойствам, при охлаждении вступают в химиче-
ское взаимодействие и образуют химические соединения, кристаллическая ре-
шетка которых отличается от кристаллических решеток исходных компонентов
(Pb – Mg, Pb – Sb). Химические соединения, образующиеся в таких системах, об-
ладают различной степенью устойчивости. Если химическое соединение устой-
чиво при всех температурах, вплоть до температуры плавления, и при плавлении
составы жидкой фазы и химического соединения тождественны, тогда соедине-
ние имеет конгруэнтную точку плавления (т.е. плавится без разложения). Если
же химическое соединение устойчиво лишь до определенной температуры и при
плавлении составы исходной твердой фазы и полученной жидкой фазы не совпа-
дают, тогда соединение имеет инконгруэнтную точку плавления (т.е. плавится
с разложением).
Все типы диаграмм более подробно рассмотрены в [4] и [13].
Частным случаем комплексного физико-химического анализа является тер-
мографический анализ, в основе которого лежит установление температур фазо-
вых превращений при медленном охлаждении изучаемых составов. Графиче-
скую зависимость температуры системы от времени при ее медленном охлажде-
нии называют кривой охлаждения. Каждому фазовому превращению на кривой
охлаждения соответствует определенный геометрический образ: точка перегиба,
температурная площадка.
При охлаждении однокомпонентной системы находящейся в расплавленном
состоянии, ( Ф = 1 , C 1 1 1 1= − + = ), плавный ход кривой охлаждения в точке 2
(рис. 4.1, а) прерывается и образуется температурная площадка, обусловленная
процессом кристаллизации, который сопровождается выделением скрытой теп-
лоты. В результате температура в течение некоторого времени остается постоян-
ной ( Ф 2= , C 1 2 1 0= − + = ). Когда весь расплав закристаллизуется (затвердеет)
опять наблюдается плавное снижение температуры ( Ф 1= ,C = − + =1 1 1 1).
При охлаждении двухкомпонентной системы (рис. 4.1, б) точка 2 также соот-
ветствует началу выделения из расплава кристаллов одного из компонентов. Вы-
деляющаяся теплота замедляет процесс охлаждения и на кривой охлаждения на-
блюдаем перегиб в точке 2. На участке 2 – 3 система двухфазная ( Ф = 2 ,
С = − + =2 2 1 1 ), однако по мере охлаждения расплав обогащается вторым ком-
понентом. При некоторой температуре (точка 3) состав жидкой фазы становится

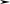

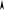
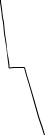


насыщенным относительно обоих компонентов и происходит их одновременная
кристаллизация. Состав, соответствующий одновременной кристаллизации
обоих компонентов называется эвтектическим, а температура, при которой
кристаллизуется этот состав называется эвтектической. В этом случае в рав-
новесии находятся три фазы: расплав и кристаллы обоих компонентов, что соот-
ветствует инвариантному состоянию ( Ф = 3, С = − + =2 3 1 0 ). Значение С = 0
указывает на то, что три фазы могут находится в равновесии при вполне опреде-
ленных условиях: температура равна эвтектической, а состав расплава соответ-
ствует эвтектическому. При охлаждении расплава эвтектического состава кри-
сталлизация обоих компонентов происходит одновременно и на кривой охлаж-
дения образуется температурная площадка (участок 3 – 4). После завершения
кристаллизации (участок 4 – 5) система состоит из двух твердых фаз (смесь кри-
сталлов двух компонентов) и является одновариантной ( Ф = 2 ,
С = − + =2 2 1 1 ), что соответствует плавному изменению хода кривой охлажде-
ния.
Если в системе образуются твердые растворы одного компонента в другом,
то на кривой охлаждения (рис. 4.1, в) наблюдаются два перегиба, соответствую-
щие температурам начала (точка 2) и конца кристаллизации (точка 3). Отсутст-
вие горизонтального участка на кривой охлаждения обусловлено тем, что состав
жидкой фазы системы при охлаждении не совпадает с составом твердого раство-
ра.
По кривым охлаждения, каждая из которых соответствует определенной
концентрации компонентов, строят диаграмму состояния. На координатную сет-
ку «состав — температура» наносят все температурные остановки и перегибы,
имеющиеся на кривых охлаждения. Соединив точки начала кристаллизации, по-
лучим линию ликвидус, выше которой система находится в расплавленном со-
стоянии. Соединив точки конца
27
1
2 3
а)
4
1
2
3
4
б)
5
1
2
в)
3
4
кристаллизации, получим линию
солидус, ниже этой температуры
система находится в твердофазном
состоянии. Между линиями ликви-
дус и солидус находится двухфаз-
ная область, в которой сосущест-
вуют жидкая и твердая фазы.
Любая точка на диаграмме, оп-
ределяющая состав и температуру
смеси, называется фигуративной.
Для определения состава фаз в
двухфазной области через точку,
Рис. 4.1. Кривые охлаждения
Время
задающую состав смеси, проводят
изотерму до пересечения с линией
однокомпонентной системы (а)
и двухкомпонентной (б, в)
ликвидус с одной стороны и с ор-
динатой с другой стороны. Проек-

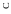
ция точки пересечения изотермы с линией ликвидус на ось абсцисс позволит оп-
ределить состав жидкой фазы, а с ординатой — состав твердой фазы.
В однофазной области состав фазы определяется проекцией точки, задающей
состав, на ось абсцисс.
Относительное количество жидкой и твердой фазы в смеси можно рассчитать
по правилу рычага: отношение масс равновесных фаз обратно отношению
отрезков, отсекаемых на изотерме ординатой общего состава системы.
Пример
Постройте диаграмму состояния системы Pb – Mg по следующим данным:
28
содержание Мg, мас. %
содержание Pb, мас. %
t нач. кр,°С
t конца кр, °С
0
100
323
323
3
97
250
250
19
81
550
550
32,5
67,5
460
460
70
30
590
460
100
0
650
650
Приведите полное название диаграммы, рассчитайте формулу химического
соединения и обозначьте фазовые поля. Постройте кривую охлаждения для со-
става с 20 мас. % Рb, определите число фаз и число степеней свободы на каждом
участке кривой охлаждения, при этом укажите, как изменяются составы фаз в
процессе кристаллизации. Для указанного состава при t 530 C= ° определите:
а) массы жидкой и твердой фаз, находящихся в равновесии, если общая масса
сплава составила 1 кг; б) массы Рb и Мg, находящиеся в жидкой фазе.
Решение
Для построения диаграммы состояния (рис. 4.2) на оси абсцисс отложим от-
резок АВ, длину которого примем за 100 мас. %. Разделим отрезок на 10 равных
частей. Крайние точки А и В соответствуют 100 мас. % Pb и 100 мас. % Mg. На
ординатах, проведенных в точках А и В, отметим температуры кристаллизации
чистых металлов 323 и 650 °С. Характерные точки начала и конца кристаллиза-
ции для различных смесей перенесем в соответствии с составом на координат-
ную сетку. Соединим температуры начала кристаллизации чистых металлов и их
сплавов. Линия t E D E tA1 2 B является линией ликвидус. Проведем через точки
E1и E2прямые, параллельные оси абсцисс, до пересечения с ординатами чис-
тых металлов и химического соединения и получим линию солидус, состоящую
из двух отрезков pq и ks. Построенная диаграмма (рис. 4.2) называется диа-
граммой состояния бинарной системы с образованием химического соеди-
нения, плавящегося без разложения (конгруэнтно). Точка D называется точ-
кой дистектики и соответствует температуре кристаллизации (плавления) хи-
мического соединения. Линия DС определяет состав химического соединения.
Точки E1и
E2называется эвтектическими, соответствующими равновесному
существованию трех фаз: жидкой фазы (L), кристаллов Pb и кристаллов химиче-
ского соединения (точка E1) и жидкой фазы (L), кристаллов химического соеди-

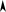



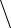





























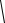
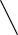

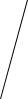










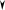
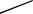
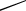
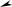








600
500
400
tA
II
D
k
I
IV
E2
n
M
1
H V
2
tB
m
s
M
1
2 2
29
300
p
200
100
A
III
E1
VI
q
C
VII
3B
3
100 % Pb
20
40
60
80
100 % Mg
Время
мас. %
Рис. 4.2. Диаграмма состояния системы Mg – Pb
нения и кристаллов Mg (точка E2).
Рассчитаем формулу химического соединения. Обозначим число атомов Pb и
Mg в формуле химического соединения через x и y соответственно. Атомные
массы этих элементов равны 207 и 24. Тогда массы свинца и магния в химиче-
ском соединении относятся как 207x : 24y . Так как химическое соединение со-
держит 81% Pb и 19% Mg, тогда
207x : 24y 81:19 ,
откуда
=
81 19
x : y
:
207 24
или x : y 0,4 : 0,8 либо
x : y 1: 2 ,
Таким образом, простейшая формула химического соединения PbMg2.
На полученной диаграмме имеется 7 областей (фазовых полей). Выше линии
ликвидус (область I) Pb и Mg находятся в жидком (расплавленном) состоянии.
=
Область I отвечает однородному однофазному состоянию ( Ф 1). Области II, III,
IV, V, VI, VII отвечают неоднородным двухфазным состояниям системы ( Ф = 2 ):
II — твердая фаза (кристаллы) Pb и жидкая фаза расплава Pb и Mg; III, IV —
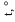
30
твердая фаза химического соединения PbMg2и жидкая фаза расплава Pb и Mg;
V — кристаллы Mg и жидкая фаза расплава Pb и Mg; VI — две твердые фазы:
кристаллы Pb и кристаллы PbMg2, VII — кристаллы Mg и кристаллы химическо-
го соединения PbMg2.
Рассмотрим процессы кристаллизации состава, содержащего 20 мас. % Pb
(точка M), и построим кривую охлаждения в координатах «температура – вре-
= = − + =2 2 1 1 ),
мя». В точке M система находится в жидком состоянии ( Ф 1, C
состав жидкой фазы соответствует 20 % Pb и 80 % Mg.
При температуре, соответствующей точке 1, из расплава начинают выделять-
ся кристаллы Mg, система становится двухфазной Ф = 2 , C 2 2 1 1= − + = . Состав
жидкой фазы соответствует 20 % Pb и 80 % Mg, твердой — кристаллам Mg. По
мере снижения температуры в расплаве увеличивается количество кристалличе-
ской фазы без изменения ее состава. Жидкая фаза обогащается свинцом, а со-
став ее изменяется по линии ликвидус. Выделяющаяся теплота при кристалли-
зации замедляет процесс охлаждения и участок 1 – 2 на кривой охлаждения име-
ет более пологий наклон.
При температуре, соответствующей точке 2, в равновесии находятся три фа-
зы: жидкая (состав ее соответствует точке E2 32,5 % Mg и 67,5 % Pb), кристаллы
PbMg2 (состав 19 % Mg, 81 % Pb) и кристаллы Mg. Система инвариантна ( Ф = 3,
C 2 3 1 0= − + = ), на кривой охлаждения образуется температурная площадка (2 –
2).
При дальнейшем охлаждении расплав кристаллизуется полностью и система
состоит из двух твердых фаз — кристаллов Mg и кристаллов PbMg2 ( Ф = 2 ,
C 2 2 1 1= − + = ). Фазовых превращений в интервале 2 – 3 не происходит и кривая
охлаждения имеет плавный ход. M – 1 – E2 — путь кристаллизации.
Для расчета масс соответствующих фаз при t 530 C° (точка H) проведем
через нее изотерму, параллельную оси абсцисс, до пересечения с линией ликви-
дус (точка n) и ординатой (точка m).
Согласно правилу рычага, запишем
m
ж
m
=H
mкр
n
H.
Обозначим массу жидкой фазы в точке H как х, тогда масса твердой фазы (кри-
сталлы Mg) — 1− x . Длины отрезков mH и nH определим по процентным соот-
ношениям: mH 100 % 80 % 20 %= − = ; nH 80 % 50 % 30 %= − = . Тогда:
x
2
=0 x 0,4 кг .
1 x 30
Следовательно, масса жидкой фазы составляет 0,4 кг, а масса кристаллов Mg
равна 1,0 0,4 0,6− = кг .
Рассчитаем массы Pb и Mg, содержащиеся в жидкой фазе. Так как состав
жидкой фазы в точке H соответствует 50 мас. % Pb и 50 мас. % Mg, то
0,4 50 0,4 50
31
m
Pb
=
100
= 0, 2 кг ,
m
Mg
=
100
= 0,2 кг .
