
Реакция барбитуратов и их натриевых солей с раствором сульфата меди (II)
Лекарственное вещество |
Результат реакции |
Барбитал |
Синее окрашивание и осадок красно-сиреневого цвета |
Фенобарбитал |
Осадок бледно-сиреневого цвета, не изменяющийся при стоянии |
Тиопентал-натрий |
Желто-зеленое окрашивание со взвешенным осадком |
Для идентификации барбитуратов могут быть использованы реакции образования моно- и дизамещен-ных комплексов с солями меди (II) в присутствии пиридина. Комплексы имеют лиловую окраску.
При взаимодействии с ионами серебра происходит образование однозамещенных (растворимых в воде) и двузамещенных (нерастворимых в воде) солей серебра. В присутствии карбоната натрия барбитураты образуют вначале натриевую соль, затем однозамещенную серебряную:
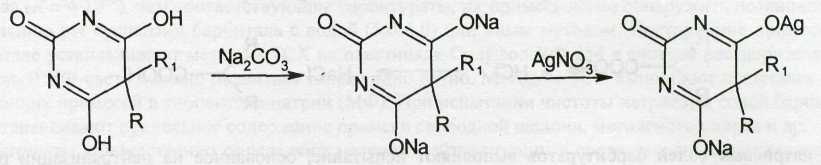
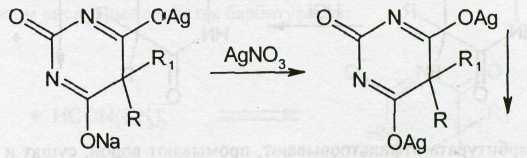
Однозамещенная серебряная соль при добавлении избытка нитрата серебра превращается в нерастворимую двузамещенную серебряную соль:
Барбитураты могут быть обнаружены с помощью общих цветных реакций на производные пиримидина, основанных на их окислении. При взаимодействии с концентрированной серной кислотой и 1-2 каплями раствора дихромата калия появляется стойкое зеленое окрашивание. Если вместо дихромата калия взять раствор ванадата аммония, то после нагревания на водяной бане раствор приобретает травянисто-зеленое окрашивание, переходящее в голубое. При сплавлении барбитурата с резорцином и концентрированной серной кислотой, последующем охлаждении и подщелачивании раствором гидроксида натрия возникает зеленая флуоресценция.
Отличающиеся по окраске продукты конденсации образуют барбитураты и их натриевые соли с альдегидами: формальдегидом (в присутствии концентрированной серной кислоты); с раствором п-диметиламинобензальдегида в концентрированной серной кислоте. При использовании в качестве реактива ванилина в присутствии концентрированной серной кислоты после кипячения появляется вишневое окрашивание, переходящее в сине-фиолетовое:

Барбитураты и их натриевые соли можно идентифицировать сплавлением с едкими щелочами, так как они при этом разрушаются с выделением аммиака:
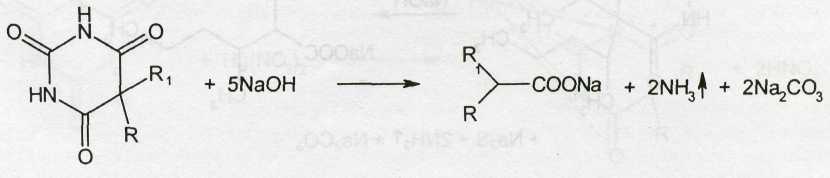
При последующем подкислении хлороводородной кислотой выделяется диоксид углерода и ощущается запах соответствующей жирной кислоты:
![]()


Выпавший осадок барбитурата отфильтровывают, промывают водой, сушат и определяют температуру плавления.
Для отличия барбитуратов друг от друга могут быть использованы реакции на функциональные группы, имеющиеся в их молекулах в положении 1 и 5. Так, фенильный радикал в фенобарбитале обнаруживают по образованию нитросоединений, окрашенных в желтый цвет. Реакция происходит после прибавления концентрированных азотной и серной кислот. Появление желтого окрашивания обусловлено образованием м-нитропроизводного фенобарбитала:

Подлинность фенобарбитала можно установить по образованию соли с ионом ртути (II) в щелочной среде. Образуется белый осадок, растворимый в избытке раствора аммиака. Фенобарбитал дает цветную реакцию с нитритом натрия в присутствии серной кислоты. При нагревании на водяной бане в течение 10 мин появляется оранжево-желтое с коричневым оттенком окрашивание.
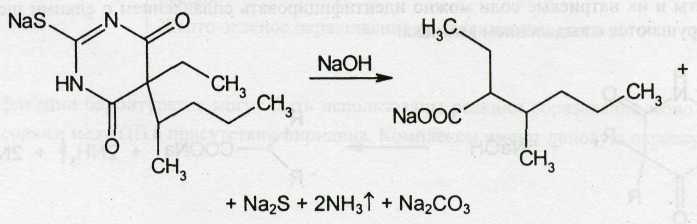
Тиопентал-натрий, содержащий атом серы в молекуле, при нагревании в присутствии гидроксида натрия и ацетата свинца образует черный осадок сульфида свинца:
![]()
Чистота.
При испытании на чистоту барбитала обнаруживают примесь этилбарбитуровой кислоты, а в фенобарбитале — примесь фенилбарбитуровой кислоты. Поскольку обе эти кислоты проявляют более сильные кислотные свойства, чем соответствующие барбитураты, их примесь легко обнаружить потенциометрически по значению рН суспензии барбитала с водой (5,0-6,0) или иным методом. Методом ТСХ выполняют испытание на наличие посторонних примесей в тиопентале-натрии (МФ). При испытании чистоты натриевых солей барбитуровой кислоты устанавливают предельное содержание примеси свободной щелочи, метилового спирта и др.
Количественное определение.
Барбитураты количественно определяют методом нейтрализации в среде неводных растворителей. Навески растворяют в нейтрализованном диметилформамиде или смеси диметилформамида и бензола (барбитал). Диметилформамид используют в качестве растворителя при титровании более сильных кислот (рКа 7,3-7,8), например, барбитала, фенобарбитала. Титруют 0,1 М раствором гидроксида натрия (в смеси метанола и бензола), используя индикатор тимоловый синий. Диметилформамид, являясь основным растворителем, присоединяет протон, усиливая при этом кислотные свойства барбитуратов:
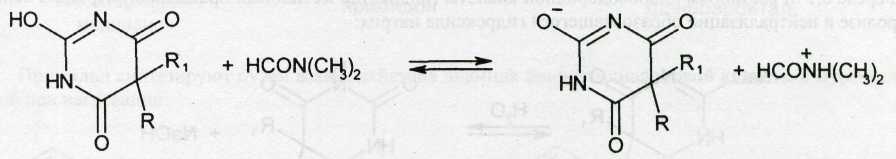
При последующем титровании гидроксидом натрия выделяются диметилформамид, вода и ион натрия. Последний с анионом барбитурата образует натриевую соль:
![]()

Барбитураты можно также титровать в присутствии индикатора тимолфталеина в среде этанола или ацетона. Водно-спиртовые растворы усиливают кислую реакцию. Присутствие спирта (ацетона) улучшает растворимость и предотвращает гидролиз образующихся натриевых солей барбитуратов.
Количественное определение бензобарбитала выполняют в спиртовом растворе, титруя его 0,1 М раствором гидроксида натрия до синего окрашивания (индикатор тимоловый синий).
Реакцию взаимодействия производных барбитуровой кислоты с ионом ртути (II), в результате которой образуются нерастворимые в воде соединения, используют для меркуриметрического определения, сочетая его с комплексонометрией. Кислотные формы барбитуратов растворяют в этаноле, натриевые соли — в воде, добавляют 10%-ный раствор ацетата натрия и избыток 0,1 М раствора нитрата ртути (II). Осадок барбитурата ртути отфильтровывают, а в фильтрате комплексонометрическим методом (титрант 0,05 М раствор трилона Б, индикатор ксиленоловый оранжевый) в присутствии гексаметилентетрамина оттитровывают избыток нитрата ртути (II).
В основе меркуриметрического определения лежит реакция между барбитуратом и нитратом ртути (II):
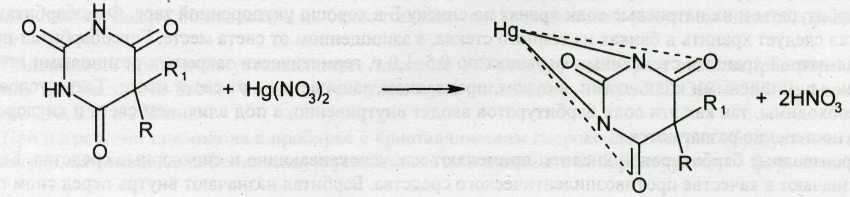

При комплексонометрическом титровании избытка нитрата ртути (II) раствором трилона Б (ЭДТА) образуется комплексное соединение ртути:
Точку эквивалентности устанавливают по изменению окраски индикатора.
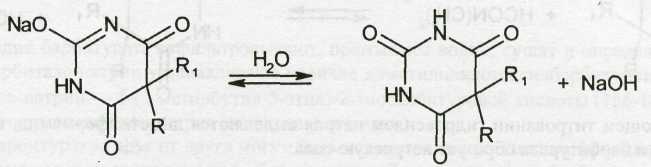
Количественное определение барбитуратов и их натриевых солей можно выполнить и аргентометриче-ским методом, основанным на образовании одно- и двузамещенных солей серебра.
![]()
Натриевые соли барбитуратов имеют в водных растворах щелочную реакцию (рН 9-11). Их титруют в водной среде 0,1 М раствором хлороводородной кислоты (индикатор метиловый оранжевый). Процесс основан на гидролизе и нейтрализации образовавшегося гидроксида натрия:
Параллельно выполняют контрольный опыт, чтобы учесть возможную примесь свободной щелочи.
Барбитураты и их натриевые соли можно также количественно определить гравиметрическим методом, осаждая или извлекая кислотные формы барбитуратов. Натриевые соли предварительно переводят в кислотные формы. В качестве экстрагентов используют эфир или хлороформ, который затем отгоняют, остаток сушат и взвешивают. Указанный гравиметрический метод рекомендован ФС для количественного определения тиопентала-натрия. Он основан на многократном извлечении хлороформом (после подкисления хлороводородной кислотой) 5-(1-метилбутил)-5-этил-2-тиобарбитуровой кислоты. После отгонки хлороформа и высушивания этой кислоты должно быть 84,0-87,0% (в пересчете на сухое вещество). По МФ хлороформные извлечения выпаривают досуха (на водяной бане) и остаток растворяют в диметилформамиде. Затем титруют, используя в качестве титранта 0,1 М раствор метилата лития (индикатор тимоловый синий). Кроме того, в тиопентале-натрии устанавливают содержание карбоната натрия (10,0-11,0%) путем титрования 0,1 М раствором хлороводородной кислоты (индикатор метиловый красный). Тиопентал-натрий можно определить иодхлорометрическим методом, основанным на окислении серы избытком 0,25 М раствора иодмонохлорида при температуре 80-90 °С.
Для количественной оценки барбитуратов и их натриевых солей используют спектрофотометрическое определение в области 239-240 нм. Растворителями при этом служат боратный буферный раствор с рН 10 (барбитал,) или 1%-ный раствор аммиака (фенобарбитал). В указанных условиях барбитал имеет максимум поглощения при 240 нм (550), барбитал-натрий при 239 нм (500), фенобарбитал при 240 нм (440), тиопентал-натрий при 255 нм (363), 305 нм (825) и 239 нм (488). В скобках указана величина удельного показателя поглощения, по которой рассчитывают содержание барбитурата. Разработана унифицированная методика спектрофотометрического определения фенобарбитала в таблетках при длине волны 240 нм (растворитель — боратный буферный раствор с рН 9,6-9,8). Известны многочисленные методики фотометрического определения барбитуратов в лекарственных формах, основанные на рассмотренных выше цветных реакциях.
