
Государственное бюджетное образовательное
учреждение высшего профессионального образования
«Воронежская государственная медицинская академия имени Н.Н. Бурденко»
Министерства здравоохранения и социального развития Российской Федерации
Кафедра фармацевтической химии и фармацевтической технологии
Лекция (методическая разработка) № 2
для студентов 3 курса, специальность 060108.51 – Фармация
ТЕМА: Лекарственные средства из группы аминоспиртов и их производных.
ЦЕЛЬ: Способствовать формированию системы теоретических знаний по определению качества лекарственных средств из группы аминоспиртов и их производных.
ВРЕМЯ ЛЕКЦИИ: 2 часа
ОСНОВНЫЕ ВОПРОСЫ:
1. Алкалоиды, производные фенилалкиламинов.
1.1 Подлинность.
1.2 Чистота.
1.3 Количественное определение.
1.4 Хранение и применение.
2. Катехоламины.
2.1 Получение.
2.2 Физические свойства.
2.3 Подлинность.
2.4 Чистота.
2.5 Количественное определение.
2.6 Хранение и применение.
ВЫВОДЫ: Студенты ознакомлены с особенностями проведения контроля качества лекарственных средств из группы производных пара-аминофенола, а также аминокислот ароматического ряда.
ВОПРОСЫ И ЗАДАНИЯ ДЛЯ САМОПРОВЕРКИ СТУДЕНТОВ.
1. Напишите структурные формулы, укажите латинские и рациональные названия кислоты глутаминовой, кислоты аминокапроновой, кислоты аскорбиновой.
2. Укажите и назовите функциональные группы, имеющиеся в молекулах.
3. Приведите описание перечисленных выше лекарственных средств (агрегатное состояние, цвет, запах), укажите их растворимость в воде и органических растворителях.
4. Охарактеризуйте кислотно-основные свойства аминокислот. Приведите химизм общегрупповых реакций на примере реакций: образования внутренних солей, этерофикации, декарбоксилирования, восстановления, ацилирования, окисления, взаимодействие с формальдегидом, образование внутрикомплексных соединений с ионами тяжелых металлов, нингидриновая проба.
5. Приведите химизмы специфических реакций на аминокислоты.
6. Опишите химические свойства кислоты аскорбиновой (реактивы, условия, эффекты реакций). Напишите соответствующие уравнения химических реакций.
7. Укажите физические константы, используемые для определения чистоты и подлинности кислоты аскорбиновой, напишите формулу расчета удельного вращения.
8. Укажите возможные примеси и дайте обоснование методикам их определения.
9. Назовите методы количественного определения изучаемых препаратов (титриметрические и физико-химические). Напишите соответствующие уравнения химических реакций.
10. Напишите формулы расчета количественного содержания веществ в г и % для предложенных вами методик количественного определения.
11. Опишите условия хранения и медицинское применение, возможные пути метаболизма изучаемых лекарственных средств, стабилизаторы аскорбиновой кислоты.
ЛИТЕРАТУРА. Беликов В.Г. Фармацевтическая химия. В 2 ч. Ч. 2. Специальная фармацевтическая химия. – Пятигорск, 1996. – 608 с.
ЛЕКЦИЯ ПОДГОТОВЛЕНА:
Методическая разработка утверждена на заседании кафедры № ___ от «____»
Зав. кафедрой, доцент ________________________ (Дурицын Е.П.)
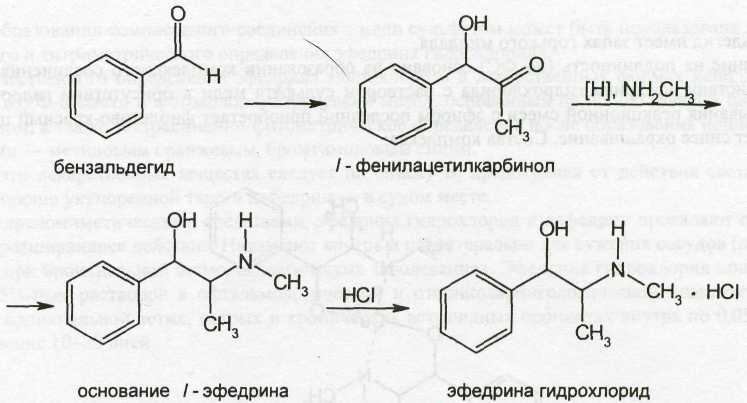
Алкалоиды, производные фенилалкиламинов.
Относящийся к этой группе алкалоид эфедрин и его диастереомер псевдоэфедрин содержатся (0,5-2%) в различных видах эфедры, семейства эфедровых (Ephedraceae). Наибольшее количество эфедрина содержится в забайкальской эфедре (Ephedra monosperma), которая является основным сырьем для его получения. Извлекают эфедрин из сырья горячей водой. Разделение эфедрина и псевдоэфедрина осуществляют перекристаллизацией оксалатов (оксалат псевдоэфедрина лучше растворим в воде).
Возрастающая потребность в эфедрине и сокращение запасов дикорастущего сырья обусловили необходимость создания промышленных способов его синтеза. Определенные трудности в синтезе эфедрина, аналогичного природному алкалоиду, обусловлены образованием нескольких его изомеров. Ввиду наличия в молекуле двух асимметрических атомов углерода эфедрин может существовать в виде двух диастереомеров: эфедрина (эритро-изомер) и псевдоэфедрина (трео-изомер). Каждый из них представляет собой рацемат и состоит из двух оптических антиподов: лево- и правовращающего.
Следовательно, изомеры эфедрина и псевдоэфедрина имеют различную пространственную структуру:
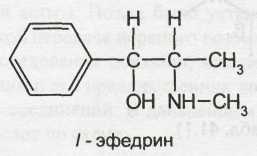
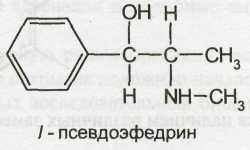
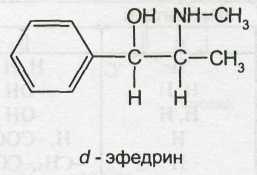
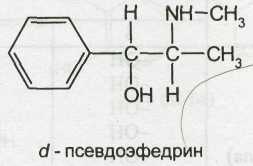
Ephedrine Hydrochloride — эфедрина гидрохлорид
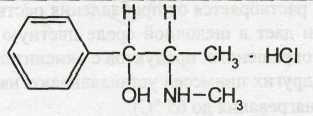
l-эритро-2-метил-амино-1 -фенилпропанола-1 гидрохлорид
Белый кристаллический порошок без запаха. Т. пл. 216 — 221°С. Удельное вращение от -33 до -36° (5%-ный водный раствор).
Эфедрина гидрохлорид, как и другие соли органических оснований, легко растворим в воде, растворим в этаноле, практически нерастворим в эфире. Эфедрина гидрохлорид даёт положительную реакцию на хлориды. Основание эфедрина растворимо в воде, поэтому при действии растворов едких щелочей на раствор гидрохлорида осадок не выпадает. Этим эфедрина гидрохлорид отличается от многих других солей алкалоидов.
Подлинность.
Подлинность эфедрина гидрохлорида можно подтвердить спектрофотометрическим методом. УФ-спектр 0,05%-ного водного раствора эфедрина гидрохлорида имеет в области 230-300 нм три максимума (251, 257 и 263 нм) и два минимума (253 и 261 нм) поглощения.
Обнаружить основание эфедрина можно путём его разрушения до образования бензальдегида при нагревании с различными окислителями, например, гексацианоферратом (III) калия:
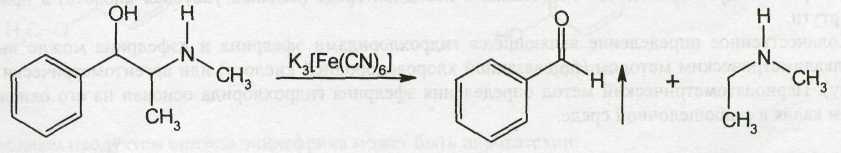
Бензальдегид имеет запах горького миндаля.
Испытание на подлинность (по ФС) основано на образовании комплексного соединения синего цвета при взаимодействии эфедрина гидрохлорида с раствором сульфата меди в присутствии гидроксида натрия. После взбалтывания реакционной смеси с эфиром последний приобретает фиолетово-красный цвет, а водный слой сохраняет синее окрашивание. Состав комплекса:
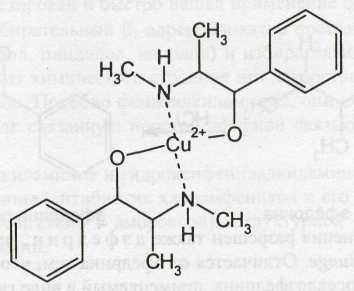
Отличить эфедрин от других арилалкиламинов можно с помощью фосфорномолибденовой кислоты по образующемуся желтому осадку, который растворяется от прибавления раствора аммиака. Подобно аминокислотам, аминоспиртам и аминофенолам, он дает в щелочной среде цветную реакцию с нингидрином (темно-фиолетовое окрашивание), но не образует окрашенных продуктов с окислителями, как аминофенолы.
Чистота.
При испытании на чистоту в числе других примесей устанавливают наличие солей аммония (по выделению аммиака после добавления щелочи и нагревания до 65 °С).
Количественное определение.
Методика количественного определения эфедрина гидрохлорида в неводной среде основана на использовании в качестве растворителей муравьиной кислоты и уксусного ангидрида. Такое сочетание растворителей подавляет диссоциацию хлороводородной кислоты, что позволяет осуществлять титрование без участия ацетата ртути (II). Титрантом служит хлорная кислота (индикатор кристаллический фиолетовый):
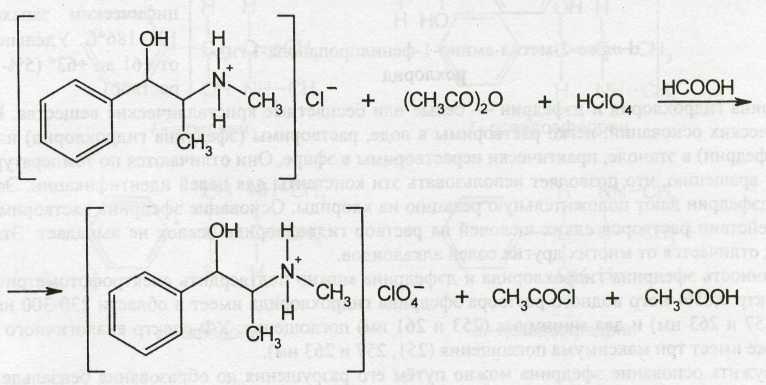
МФ рекомендует проводить титрование в неводной среде (ледяная уксусная кислота) в присутствии ацетата ртути.
Количественное определение являющимся гидрохлоридом эфедрина можно выполнить также алкалиметрическим методом (по связанной хлороводородной кислоте) или аргентометрически (по хлорид-иону). Периодатометрический метод определения эфедрина гидрохлорида основан на его окислении периодатом калия в слабощелочной среде.
Реакция образования комплексного соединения с меди сульфатом может быть использована для фотоколориметрического и титриметрического определения эфедрина гидрохлорида.
Для количественного определения эфедрина гидрохлорида в лекарственных формах используют спектрофотометрию в УФ-области и фотоколориметрический метод, основанный на использовании цветной реакции с нингидрином, а также экстракционно-фотометрическое определение после образования ионных ассоциатов с красителями — метиловым оранжевым, бромтимоловым синим.
Хранение и применение.
Хранить эти лекарственные вещества следует по списку Б, предохраняя от действия света, эфедрина гидрохлорид в хорошо укупоренной таре.
Являясь адреномиметическим средством, эфедрина гидрохлорид проявляет сосудосуживающее, бронхорасширяющее действие. Назначают внутрь и парентерально для сужения сосудов (при травмах, потерях крови), при бронхиальной астме, аллергических заболеваниях. Эфедрина гидрохлорид применяют местно в виде 2-5%-ных растворов в офтальмологической и оториноларингологической практике.
Катехоламины.
Общая формула катехоламинов может быть представлена следующим образом:
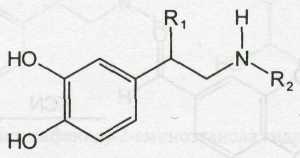
где R1 = Н; ОН; R2 = Н; СН3.
В качестве лекарственных веществ применяют: допамин (дофамин), эпинефрин (адреналин), эпинефрина гидротартрат, норэпинефрина (норадреналина) гйдротартрат.
Получение.
Природным источником получения адреналина и кортикостероидов служат надпочечники крупного рогатого скота и свиней. Надпочечники — парные железы, состоящие из двух слоев: коркового и мозгового. Мозговой слой вырабатывает гормон адреналин, а корковый — около 40 различных гормонов, известных под названием кортикостероиды. Гормоны экстрагируют 80%-ным этиловым спиртом. Белки денатурируются, а из экстракта отгоняют спирт. Оставшийся водный раствор обезжиривают с помощью петролейного эфира, затем подкисляют и добавляют дихлорэтан. Дихлорэтан извлекает кортикостероиды, а в подкисленном растворе остается адреналина гидрохлорид. Остатки сопутствующих веществ из раствора удаляют, действуя раствором ацетата свинца. Очистку адреналина от примесей производят, последовательно превращая его в адреналин-основание (с помощью раствора аммиака), а затем и в адреналина битартрат (действием винной кислоты). Этот процесс повторяют несколько раз.
Адреналин впервые выделен русским ученым Н.О. Цибульским в конце XIX в., а в 1903 г. установлена его химическая структура, которая была подтверждена синтезом. В последующие годы был выделен сопутствующий адреналину гормон норадреналин, его предшественник дофамин и осуществлен их синтез.
Исходным продуктом синтеза эпинефрина может быть пирокатехин:
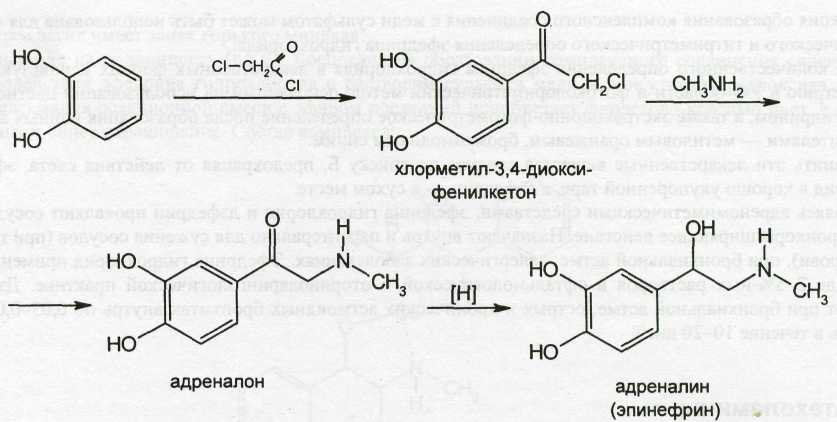
Синтез норэпинефрина также осуществляют из пирокатехина путём последовательного формилирования, цианирования, гидрирования:
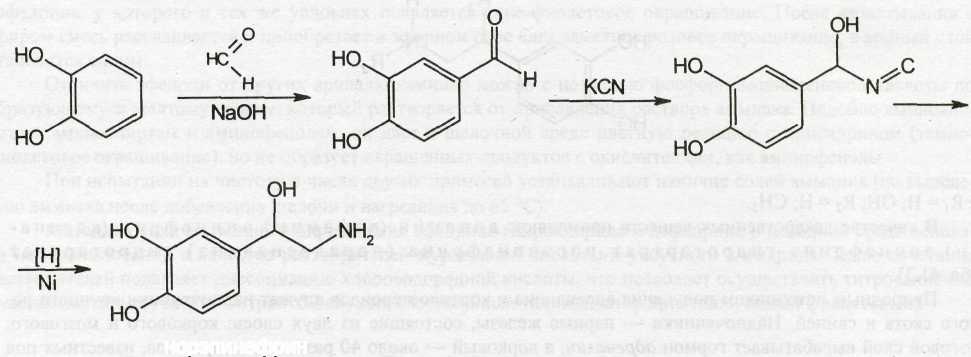
Наличие асимметрических углеродных атомов в молекулах эпинефрина и норэпинефрина обусловливает существование оптических изомеров. Полученные в результате синтеза рацематы разделяют с помощью винной кислоты. Применяют в медицине полученный из надпочечников скота или синтетический эпинефрин и гидротартраты левовращающих оптических изомеров эпинефрина и норэпинефрина. Они в 12 раз более активны по сравнению с правовращающими антиподами. Катехоламины являются амфолитами. Кислотные свойства им придают, имеющиеся в молекуле фенольные гидроксилы. Наличие первичной (норэпинефрин) или вторичной (эпинефрин) аминогрупп в молекулах придает основные свойства и обусловливает способность образовывать соли.
Физические свойства.
Катехоламины представляют собой белые кристаллические вещества. Они могут иметь сероватый или желтоватый оттенок. ГФ предусматривает контроль содержания оптических изомеров в эпинефрине, его битартрате и норэпинефрина битартрате.
Epinephrine — эпинефрин (Адреналин)
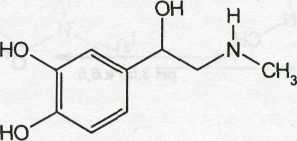
l-1 -(3',4'-диоксифенил)-2-метиламиноэтанол
Белый или кремово-белый мелкокристаллический порошок без запаха. Изменяет окраску под влиянием воздуха и света. Удельное вращение от -50 до -54° (4%-ный раствор в 1 М хлороводородной кислоте).
Epinephrine Bitartrate — эпинефрина битартрат (Адреналина гид-ротартрат)

Белый или белый с сероватым оттенком кристаллический порошок без запаха. Т. пл. 147-152°С (с разложением). Легко изменяется под действием света и кислорода воздуха.
Norepinephrine Bitartrate — норэпинефрина битартрат (Норадреналина гидротартрат)
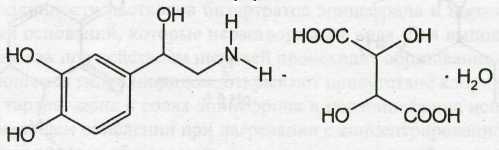
l-1-(3',4'-диоксифенил)-2-аминоэтанола гидротартрат
Белый или почти белый кристаллический порошок без запаха, горького вкуса. Т. пл. 100-106°С. Удельное вращение от -10 до -12° (2%-ный водный раствор).
Эпинефрина битартрат необходимо предварительно отделить от оптически активной винной кислоты, превратить его в основание, а затем в гидрохлорид, удельное вращение раствора которого должно быть от -48 до -54°. Эпинефрин (основание) очень мало растворим в воде, умеренно растворим в 0,1 М хлороводородной кислоте, практически нерастворим в этаноле и хлороформе.
Лекарственные вещества, являющиеся солями, легко растворимы в воде и практически нерастворимы в эфире и хлороформе. В этаноле эпинефрина и норэпинефрина битартраты мало или очень мало растворимы. Являясь фенолами, все они растворяются в растворах щелочей с образованием фенолятов (феноксидов).
