
ЛЕКЦИЯ по теме: «ПРОИЗВОДНЫЕ ПИРИМИДИНА»
Общая характеристика.
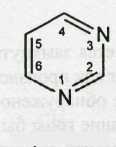
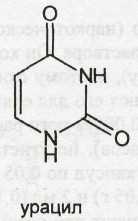
Пиримидин — составная часть структуры молекул синтетических и биологически активных природных лекарственных веществ (алкалоидов, витаминов). Он представляет собой шестичленный гетероцикл с двумя атомами азота в положении 1 и 3.
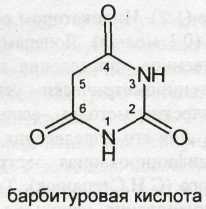
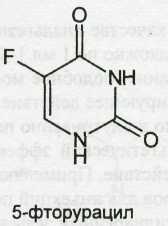
Из синтетических соединений пиримидина в качестве лекарственных веществ наиболее широко применяют производные барбитуровой кислоты (пиримидин-2,4,6-трион). Среди них целый ряд эффективных снотворных, противоэпилептических и наркотических средств. Мало отличаются по химическому строению и фармакологическому действию от производных барбитуровой кислоты соединения, структурной основой которых является гексагидропиримидиндион (примидон). Из конденсированных систем в медицине применяют производные бензопиримидина (хиназолина), обладающие гипотензивным действием.
Производные барбитуровой кислоты.
Производные барбитуровой кислоты, или циклические уреиды, в отличие от ациклических уреидов представляют собой продукты взаимодействия полного амида угольной кислоты (мочевины) с производными малоновой кислоты:
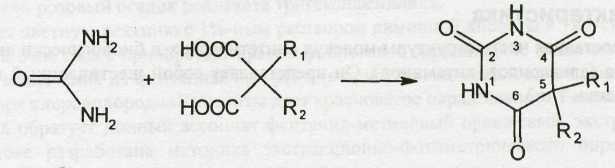
Поскольку в результате конденсации образуется замкнутая циклическая система с двумя атомами азота (в положении 1 и 3), то барбитураты рассматривают как производные пиримидина.
Снотворное действие барбитуратов впервые обнаружено в начале XX в. Э.Фишером и Ф.Мерингом. В 1904 г. Э.Фишером получен барбитал. В последующие годы было синтезировано большое число барбитуратов и установлен ряд закономерностей между их химической структурой и действием на организм.
Структура молекул обусловливает особенности химических свойств барбитуратов. Производные барбитуровой кислоты способны проявлять лактим-лактамную таутомерию (за счет водородов имидных групп):
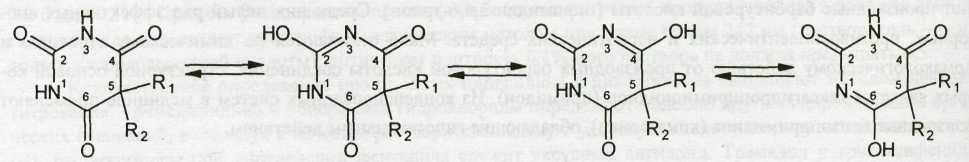
Лактимная или аци-форма обусловливает кислотный характер производных барбитуровой кислоты. В присутствии гидроксид-ионов они диссоциируют как кислоты и образуют соли с металлами:
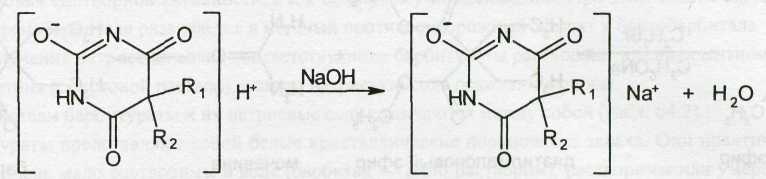
Применяемые в медицинской практике производные барбитуровой кислоты, можно разделить на две группы: барбитураты (лактамная форма) и натриевые соли барбитуратов (лактимная форма). Общие формулы могут быть представлены следующим образом:
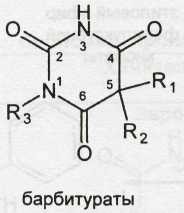
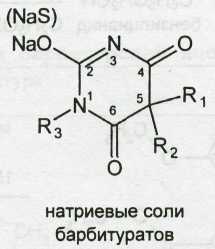
Барбитураты — барбитал, фенобарбитал — и натриевые соли — барбитал-натрий, тиопентал-натрий различаются по характеру радикалов R1 R2 и R3.
Синтез.
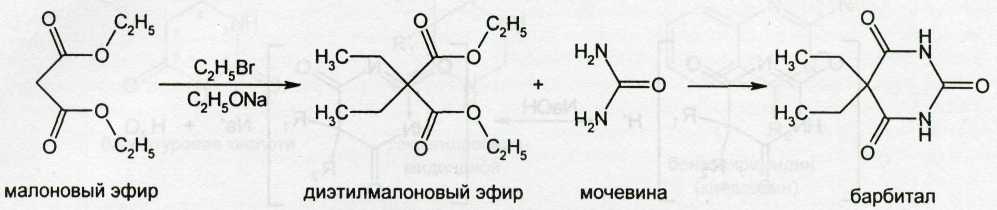
Синтез производных барбитуровой кислоты, состоит из двух этапов. Вначале получают соответствующий эфир малоновой кислоты. На втором этапе синтеза осуществляют его конденсацию с мочевиной (в присутствии алкоголята натрия в среде абсолютного спирта).
Барбитал получают по схеме:
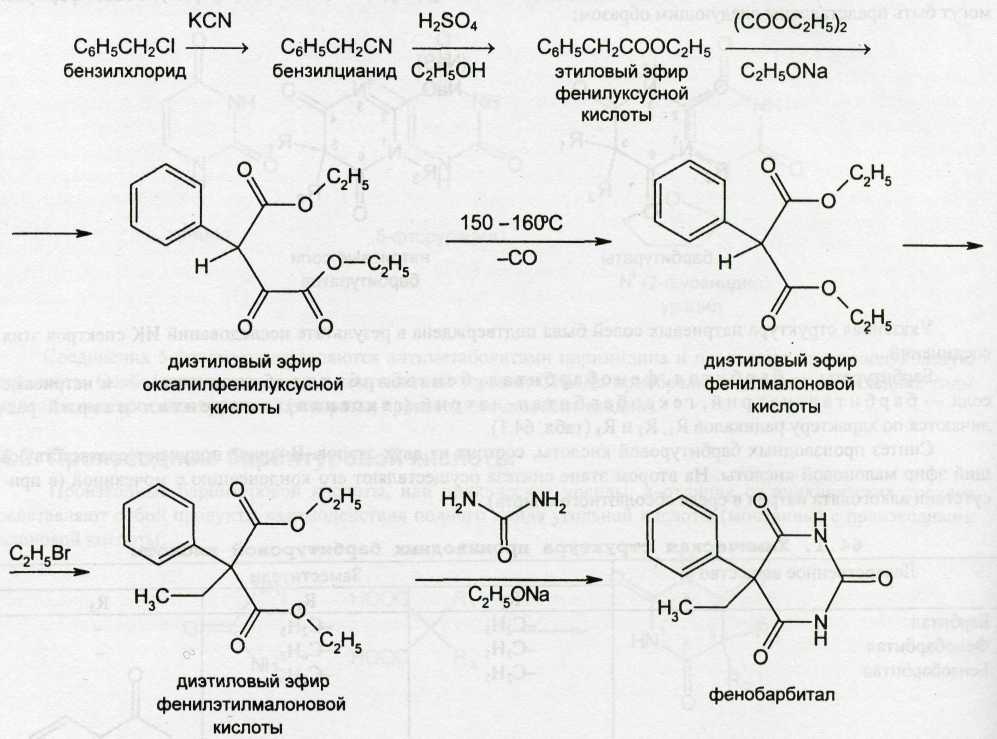
Из фенобарбитала получают бензобарбитал, действуя бензоилхлоридом:
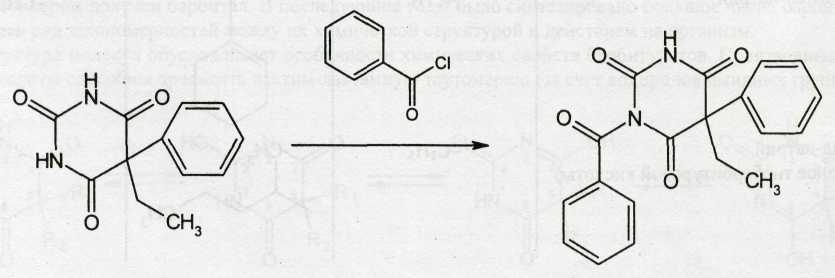
Для получения натриевых солей соответствующие барбитураты растворяют в эквивалентном количестве гидроксида натрия (спиртовой раствор), а затем натриевую соль осаждают эфиром.
По свойствам барбитураты и их натриевые соли отличаются между собой.
Барбитураты представляют собой белые кристаллические порошки без запаха. Они практически нерастворимы или очень мало растворимы в воде (барбитал — мало растворим), растворимы или умеренно растворимы в этаноле и эфире (фенобарбитал — легко растворим в этаноле). Водные и спиртовые растворы барбитуратов имеют кислую реакцию (константа диссоциации барбитала 1,3-10-8, фенобарбитала 4,8-10-8). Барбитал мало, фенобарбитал умеренно. Барбитураты легко растворимы в растворах щелочей.
Barbital — барбитал
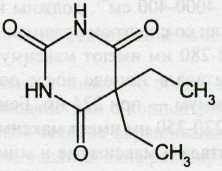
Белый кристаллический порошок без запаха. Т. пл. 189-192 °С.
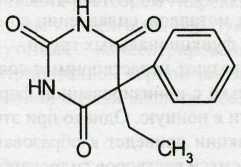
5-этил-5-фенилбарбитуровая кислота
Белый кристаллический порошок без запаха. Т. пл. 175-179 °С.
Thiopental Sodium — тиопентал-натрий
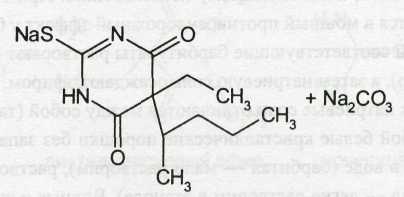
Кристаллический порошок желтоватого или желтовато-зеленоватого цвета со своеобразным запахом. Гигроскопичен.
Натриевые соли барбитуратов (тиопентала) представляют собой мелкокристаллические порошки или сухую пористую массу (тиопентал-натрий желтоватого цвета со своеобразным запахом). Они гигроскопичны, легко растворимы или очень легко растворимы в воде и этаноле, практически нерастворимы в эфире. Водные растворы натриевых солей барбитуратов имеют щелочную реакцию (рН 9,0 — 11,0).
Подлинность.
Подлинность барбитуратов можно установить по ИК-спектрам. МФ рекомендует этот метод для идентификации для фенобарбитала и тиопентала-натрия. ИК-спектры, снятые после прессования в таблетках с бромидом калия в области 4000-400 см-1, должны иметь полное совпадение полос поглощения с прилагаемым к ФС рисунком спектра или со спектром сравнения.
УФ-спектры барбитуратов в области 220-280 нм имеют максимумы и минимумы поглощения, используемые для идентификации. Раствор фенобарбитала в этаноле после добавления буферного раствора с рН 10 имеет максимум поглощения при 240 нм и минимум — при 224 нм. Барбитал и его натриевая соль имеют максимум при 239-240 нм.
Для испытания барбитуратов и их натриевых солей используют химические реакции, основанные на соле- и комплексообразовании с солями тяжелых металлов, сплавлении со щелочами, окислении, нейтрализации натриевых солей, обнаружении ионов натрия и функциональных групп.
Производные барбитуровой кислоты образуют нерастворимые соли с ионами серебра, ртути (II), меди (II), кобальта (II). Эта реакция происходит только с ионизированной формой, поэтому кислотную форму барбитурата предварительно необходимо перевести в ионную. Однако при этом нельзя допускать избытка щелочи, так как он при последующем выполнении реакции приведет к образованию гидроксидов металлов. Поэтому более целесообразно выполнять эту реакцию в смеси растворов гидрокарбоната и карбоната натрия.
Все барбитураты и их натриевые соли образуют с ионом кобальта комплексные соединения, окрашенные в сине-фиолетовый цвет (в присутствии хлорида кальция). Цветная реакция с раствором сульфата меди (II) позволяет отличать производные барбитуровой кислоты друг от друга.
