
8. Химические свойства.
Реакции электрофильного замещения в ароматическом ядре (SЕ).
Арены вступают в ионные реакции, протекающие по механизму электрофильного замещения, обозначаемого символом SE (от англ. substitution electrophilic). Реакция начинается с возникновения π – комплекса, из которого затем образуется -комплекс, и завершается стабилизацией -комплекса за счёт отщепления протона.
Механизм реакции электрофильного присоединения.
а) Образование π – комплекса:
Электрофильный реагент Е+ атакует π-электронное облако ароматического кольца, и за счёт слабого электростатического взаимодействия образуется неустойчивый π-комплекс. Ароматическая система при этом не нарушается. Эта стадия протекает быстро.

+ Е+ Е+
π – Комплекс
б) Образование σ-комплекса:
На этой медленной стадии идёт образование ковалентной связи между электрофильной частицей и одним из атомов углерода бензольного кольца. Связь образуется за счёт двух электронов кольца и сопровождается переходом одного из атомов углерода из sp2- в sp3-гибридное состояние, т. е. он становится тетраэдрическим. Ароматическая система при этом нарушается. Четыре оставшиеся π-электрона распределяются между пятью атомами углерода цикла и молекула бензола превращается в карбкатион, или σ-комплекс.
 Е
Н
Е
Н
Е+
π – Комплекс σ – Комплекс (Карбкатион)
в) Отщепление протона.
Нарушение ароматичности энергетически невыгодно, поэтому структура σ-комплекса менее устойчива, чем ароматическая структура. Для восстановления ароматичности происходит отщепление протона от атома углерода, связанного с электрофилом. При этом два электрона возвращаются в π-систему и тем самым восстанавливается ароматичность.
Е
Н
Е


- Н+
σ – Комплекс
Реакции электрофильного замещения в ароматическом ряду широко используются в промышленности для синтеза многих производных бензола.
1. Галогенирование.
Бензол не взаимодействует с хлором или бромом в обычных условиях. Реакция может протекать только в присутствии катализаторов, которыми чаще всего являются безводные галогениды алюминия AlCl3, AlBr3 и железа FeCl3, FeBr3.
 Н
Cl
Н
Cl
FeCl3, 25°С
+ Cl2 + НCl
Бензол Хлорбензол
Эта реакция используется только для получения хлор- и бром- замещённых аренов. Реакция с фтором протекает слишком бурно, так как фтор очень активен и получить фторзамещённые продукты невозможно. Реакция иодирования аренов практически не осуществляется ввиду очень низкой активности йода.
2 .
Нитрование.
.
Нитрование.
Бензол очень медленно реагирует с концентрированной азотной кислотой даже при нагревании. Однако при действии на него смеси концентрированных азотной и серной кислот, так называемой нитрующей смеси, легко происходит реакция нитрования, т. е. замещение водорода в ядре на нитрогруппу – NO2.
 Н
NO2
Н
NO2
H2SO4, 50°С
+ HNO3 + Н2O
Бензол Нитробензол
Атакующей электрофильной частицей в этой реакции является нитроил-катион NO2+, который образуется при взаимодействии азотной и серной кислот.
H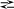 NO3
+ 2H2SO4
NO2+
+ 2HSO4-
+ Н3O+
NO3
+ 2H2SO4
NO2+
+ 2HSO4-
+ Н3O+
Нитроил- Гидрок-
катион соний
ион
3. Сульфирование.
В результате этой реакции происходит замещение водорода в бензольном ядре на сульфогруппу – SO3H. Бензол взаимодействует с дымящей серной кислотой при комнатной температуре. Дымящей называется серная кислота, в которой растворён оксид серы (VI). Именно нейтральная молекула оксида серы (VI), или триоксида серы, является электрофильным реагентом.
 Н
SO3Н
Н
SO3Н
H2SO4, 25°С
+ SO3
Бензол Оксид серы (VI) Бензолсульфокислота
В отличие от других реакций электрофильного замещения сульфирование аренов является обратимой реакцией. При нагревании с водой в кислой среде происходит обратная реакция – десульфирование с образованием исходного ароматического углеводорода.
SO3Н
H2O, t°
+ + H2SO4
Бензолсульфокислота Бензол
4. Алкилирование.
В результате этой реакции происходит введение в бензольное ядро алкильной группы с получением гомологов бензола – алкилбензолов. Эта реакция известна под названием алкилирования по Фриделю-Крафтсу (1877).
Алкилирование протекает при действии на ароматические углеводороды галогеналканов в присутствии катализаторов – галогенидов алюминия. С помощью катализатора происходит поляризация молекулы галогеналкана с образованием из неё электрофильной частицы.
R – Cl + AlCl3 R+[AlCl4]-
В зависимости от строения радикала в галогеналкане различают реакции метилирования, этилирования и т. д.
 Н
CH3
Н
CH3
AlCl3
+ CH3Cl + HCl
Бензол Метилхлорид Толуол
Реакции окисления и восстановления.
1. Окисление.
Отличительной чертой ароматических углеводородов является их устойчивость к окислению. В обычных условиях на бензол не действуют такие сильные окислители как азотная кислота, хромовая смесь, перманганат калия. По устойчивости к действию окислителей арены сходны с алканами. Однако арены, как и алканы, могут подвергаться окислению в жёстких условиях в присутствии катализаторов.
2. Восстановление.
Реакция присоединения водорода к бензолу (гидрирование) идёт в жёстких условиях в присутствии металлических катализаторов (Ni, Pt, Pd). Молекула бензола присоединяет три молекулы водорода и превращается в циклогексан, а гомологи бензола – в производные циклогексана.
СН
СН2
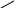

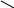
 НС СН
Н2С
СН2
НС СН
Н2С
СН2
+ 3Н2
СН2
СН
Бензол Циклогексан
Реакции в боковой цепи.
1. Галогенирование.
Гомологи бензола имеют ряд особенностей в химическом поведении, связанных с наличием в их молекулах алкильных радикалов. По химическим свойствам алкильные радикалы подобны алканам. Атомы водорода в них замещаются на галоген в условиях свободно-радикальной реакции замещения. Влияние бензольного кольца на алкильные заместители приводит к тому, что замещается всегда атом водорода у атома углерода, непосредственно связанного с ароматическим кольцом (у α-атома углерода).
 СН3
СН2Cl
СН3
СН2Cl
Cl2hν Cl2hν
- HCl - HCl
Толуол Фенилхлорметан (бензилхлорид)
 СНCl2
СCl3
СНCl2
СCl3
Cl2hν
 +
HCl
+
HCl
Фенилдихлорметан Фенилтрихлорметан
СН2СН3 СНClСН3
Cl2hν
+ HCl
Этилбензол 1-Фенил-1-хлорметан
2. Окисление.
Боковые цепи в гомологах бензола подвергаются окислению при действии сильных окислителей, таких, как азотная кислота, хромовая смесь, перманганат калия. Боковой алкильный радикал независимо от длины углеродной цепи окисляется в карбоксильную группу. Окисляемое соединение должно иметь хотя бы один атом водорода у α-атома углерода, т. е., у того, который непосредственно связан с ароматическим кольцом. Продуктами окисления являются ароматические карбоновые кислоты.
 СН3
COOH
СН2СН3
СН3
COOH
СН2СН3
[O] [O]
Толуол Бензойная кислота Этилбензол
Мезомерный эффект. Правила замещения в производных бензола.
Важнейшим фактором, определяющим химические свойства молекулы, является распределение в ней электронной плотности. Характер распределения зависит от взаимного влияния атомов.
В молекулах, имеющих только σ-связи, взаимное влияние атомов в случае их различной электроотрицательности осуществляется через индуктивный эффект. В молекулах, представляющих собою сопряжённые системы, проявляется действие другого эффекта – мезомерного, или эффекта сопряжения.
Влияние заместителя, передающееся по сопряжённой системе π-связей, называется мезомерным эффектом сопряжения, и обозначается буквой М.
Молекула бензола является сопряжённой системой с равномерным распределением электронной плотности. Однако, это равномерное распределение π-электронного облака нарушается, если в бензольное кольцо вводится какой-нибудь заместитель. Пол влиянием заместителя происходит перераспределение электронной плотности в бензольном кольце. В результате этого меняется реакционная способность ароматического кольца, прежде всего в реакциях электрофильного замещения.
Заместители можно разделить на две группы в зависимости от проявляемого ими мезомерного эффекта: электронодонорные и электроноакцепторные.
Электронодонорные заместители проявляют + М-эффект и повышают электронную плотность в сопряжённой системе. К электронодонорным заместителям относятся гидроксильная группа – ОН и аминогруппа – NH2. Неподелённая пара электронов гетероатомов этих групп вступает в общее сопряжение с π-электронной системой бензольного кольца и увеличивает длину сопряжённой системы. Под влиянием электронодонорных заместителей происходит перераспределение электронной плотности в бензольном кольце с некоторым её сосредоточением в орто- и пара-положениях.
Н
δ-
δ-
δ-
δ-
δ-
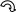
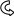
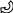
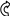

δ-
Фенол Анилин
Электроноакцепторные заместители проявляют – М-эффект и снижают электронную плотность в сопряжённой системе. К электроноакцепторным заместителям относятся нитрогруппа – NO2, сульфогруппа – SO3H, альдегидная – СНО и карбоксильная – СООН группы. Эти заместители образуют с бензольным кольцом общую сопряжённую систему. Поскольку они содержат более электроотрицательные атомы (азот, кислород), то общее π-электронное облако смещается в сторону этих групп. Таким образом электронная плотность бензольного кольца в целом понижается и в результате её перераспределения некоторый частичный отрицательный заряд возникает в мета-положении.
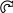
 O
O
O
O
 Н О
Н О
N C
δ-
δ-
δ-
δ-
Нитробензол Бензальдегид
Поскольку электронодонорные заместители повышают электронную плотность бензольного кольца, то они способствуют протеканию реакций электрофильного замещения. При этом вновь вступающая в молекулу электрофильная группа будет направляться уже имеющимся в бензольном кольце заместителем в орто- и пара-положения, т. е. в положения с наибольшей электронной плотностью. В связи с этим электронодонорные заместители называют заместителями I рода, или орто- и пара-ориентантами. Кроме гидроксильной группы – ОН и аминогруппы – NH2, к заместителям I рода относятся также галогены и алкильные группы. Алкильные группы не могут участвовать в общем сопряжении, но они проявляют + I-эффект, действие которого в наибольшей степени испытывает π-электронная плотность.
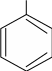 СН3
СН3
СН3
СН3
СН3
СН3
δ-


Br
δ-
Br2; FeBr3 +
 -
HBr
-
HBr
δ-
Br
Толуол о-Бромтолуол п-Бромтолуол
Замещение в производных бензола, имеющих заместители I рода, происходит легче, чем в самом бензоле.
Электроноакцепторные заместители, снижая электронную плотность кольца, понижают его реакционную способность в реакциях электрофильного замещения. Поэтому эти реакции протекают труднее, чем с бензолом. В то же время эти заместители ориентируют вновь вступающие электрофильные группы в мета-положение. В связи с этим электроноакцепторные заместители называют заместителями II рода, или мета-ориентантами. К этой группе принадлежат нитрогруппа – NО2, сульфогруппа – SO3H, альдегидная группа – СНО, карбоксильная группа – СООН. Реакции электрофильного замещения в производных бензола, имеющих заместители II рода, протекают значительно медленнее. Например, нитрование нитробензола идёт в 10 000 раз медленнее, чем нитрование бензола.
δ-
N NO2
HNO3; H2SO4
δ-
NO2
Нитробензол м-Динитробензол
