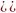Обсуждение результатов
Опыт
№1
Считая
диссоциацию электролита полной (α=1),
вычислить pH.
0,1Н
раствора HCl
0.1H
раствора
NaOH
HCl:
[H+]
= 0.1 моль/л HCl↔H++Cl-
KH2O=
[H+]*[OH-]=
10-14
H2O
↔ H++OH-
[OH-]
= KH2O/[H+]
= 10-14/10-1=10-13
моль/л
pH=
-lg0.1=1; pOH=13
NaOH↔Na++OH-
[OH-]=0.1
моль/л
pOH
= -lg0.1=1; [H+]=10-14/10-1=10-13
моль/л
pH=13
Опыт
№2
CH3COOH↔H++CH3COO-
Kдис=[H+][
CH3COO-]
CH3COOH+
CH3COONa
→ раствор оранжевого цвета, равновесия
сместилась в сторону образования CH3COOH
Определить
pH
0,1м раствора уксусной кислоты (k=1,7*10-15)
/ Как изменится pH
раствора при добавлении к 1л 0,1м раствора
уксусной кислоты 0,1моль/л ацетата натрия.
CH3COOH↔H++CH3COO-
[H+]=сα
α=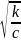 ,
α=
,
α=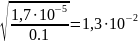
[H+]=
0,1
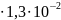 =
=
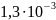 (моль/л)
(моль/л)
pH=-lg(
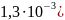 =2,89
=2,89
При
добавлении 0,1м раствора CH3COOH
CH3COO-
сместит равновесие в сторону образования
недиссоциированных молекул.
k=[H+]
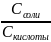 ;
[H+]=
k/
;
[H+]=
k/
[H+]=1.7*10-5
pH=-lg(1.7*10-5)=4,77
pH
раствора при добавлении к 1л 0,1м раствора
CH3COOH
0,1моль/л CH3COONa
увеличивается в 4,77/2,89=1,65 раз.
Опыт
№3
NH4OH↔
NH4++OH-
K=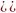


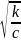 ,
α=
,
α=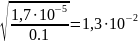
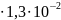 =
=
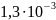 (моль/л)
(моль/л)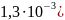 =2,89
=2,89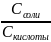 ;
[H+]=
k/
;
[H+]=
k/