
Правильной будет следующая форма записи:
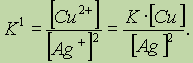
Это объясняется тем, что концентрации металлических меди и серебра введены в константу равновесия. Концентрации меди и серебра определяются их плотностью и не могут быть изменены. Поэтому эти концентрации нет смысла учитывать при расчете константы равновесия.
Аналогично объясняются выражения констант равновесия при растворении AgCl и AgI.
Произведение растворимости. Константы диссоциации малорастворимых солей и гидроксидов металлов называются произведением растворимости соответствующих веществ (обозначается ПР).
Для реакции диссоциации воды
![]()
выражение константы будет:
![]() ,
а не
,
а не
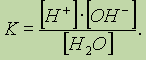
Объясняется это тем, что концентрация воды во время реакций в водных растворах изменяется очень незначительно. Поэтому принимается, что концентрация [Н2О] остается постоянной и вводится в константу равновесия.
Ионные уравнения реакций. Поскольку электролиты в растворах образуют ионы, то для отражения сущности реакций часто используют так называемые ионные уравнения реакций.Написанием ионных уравнений подчеркивается тот факт, что, согласно теории диссоциации, в растворах происходят реакции не между молекулами, а между ионами.
С точки зрения теории диссоциации при реакциях между ионами в растворах электролитов возможны два исхода:
1. Образующиеся вещества — сильные электролиты, хорошо растворимые в воде и полностью диссоциирующие на ионы.
2. Одно (или несколько) из образующихся веществ — газ, осадок или слабый электролит (хорошо растворимый в воде).
Рассмотрим две реакции:
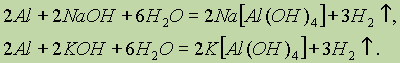
В ионной форме эти уравнения запишутся следующим образом:
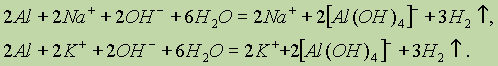
В данном случае алюминий не является электролитом, а молекула воды записывается в недиссоциированной форме потому, что является очень слабым электролитом. Неполярные молекулы водорода практически нерастворимы в воде и удаляются из сферы реакции. Одинаковые ионы в обеих частях уравнений можно сократить, и тогда эти уравнения преобразуются в одно сокращенное ионное уравнение взаимодействия алюминия с щелочами:
![]()
Очевидно, что при взаимодействии алюминия с любой щелочью реакция будет описываться уравнением. Следовательно, ионное уравнение, в отличие от молекулярного, относится не к одной какой-нибудь реакции между конкретными веществами, а к целой группе аналогичных реакций. В этом его большая практическая ценность и значение, например благодаря этому широко используются качественные реакции на различные ионы.
С учетом вышеизложенного можно сформулировать правило, которым удобно руководствоваться при изучении процессов, протекающих в растворах электролитов.
Реакции между ионами в растворах электролитов идут практически до конца в сторону образования осадков, газов и слабых электролитов.
Следовательно, реакции идут с образованием веществ с меньшей концентрацией ионов в растворе в соответствии с законом действующих масс. Скорость прямой реакции пропорциональна произведению концентраций ионов реагирующих компонентов, а скорость обратной реакции пропорциональна произведению концентраций ионов продуктов. Но при образовании газов, осадков и слабых электролитов ионы связываются (уходят из раствора) и скорость обратной реакции уменьшается.
Ионное
произведение воды. Константа
воды ![]() .
Эту константу для воды называют ионным
произведением воды. Ионное
произведение воды зависит только от
температуры; при повышении температуры
оно увеличивается.
.
Эту константу для воды называют ионным
произведением воды. Ионное
произведение воды зависит только от
температуры; при повышении температуры
оно увеличивается.
При диссоциации воды (см. уравнение выше) на каждый ион Н+ образуется один ион ОН- , следовательно, в чистой воде концентрации этих ионов должны быть одинаковы: [H+] =[ОН- ]. Используя значение ионного произведения воды, находим:
![]()
Такова концентрация ионов Н+ и ОН- в чистой воде. Рассмотрим, как изменится концентрация при добавлении других веществ, например соляной кислоты. Соляная кислота — сильный электролит, диссоциирующий в воде на ионы H+ и Cl- . Следовательно, концентрация ионов Н+ в растворе будет увеличиваться. Однако ионное произведение воды от концентрации не зависит, поэтому при увеличении [Н+] должна уменьшаться [ОН- ].
Напротив, если к воде добавить щелочь, то концентрация [ОН- ] увеличится, а [Н+] уменьшится. Таким образом, концентрации [Н+] и [ОН- ] взаимосвязаны: чем больше одна величина, тем меньше другая, и наоборот.
Кислотность растворов обычно выражают через концентрацию ионов Н+. В кислых растворах [Н+]>10-7 моль/л, в нейтральных [Н+] = 10-7 моль/л, в щелочных [Н+]< 10-7 моль/л.
рН раствора. Чтобы не писать числа с показателем степени, кислотность раствора часто выражают через отрицательный логарифм концентрации ионов водорода, называя эту величину водородным показателем и обозначая ее рН:
![]()
В кислых растворах рН < 7, в нейтральных рН = 7, в щелочных рН > 7.
Практическая часть
Опыт №1
Наливаем в первую пробирку дистиллированную воду, во вторую раствор соляной кислоты, в третью раствор гидроксида калия. Прибавим в каждую пробирку фенолфталеин, затем лакмус и метилоранж.
Индикатор |
Среда кислая, ph=1 |
Среда щелочная, pH=13 |
Среда нейтральная, pH=7 |
Фенолфталеин |
бесцветный |
малиновый |
бесцветный |
Метилоранж |
красный |
жёлтый |
оранжевый |
Лакмус |
бордовый |
тёмно-синий |
фиолетовый |
Опыт №2
В две пробирки наливаем уксусной кислоты и добавляем метилоранж. Раствор приобрёл светло-красный цвет. Одну оставляем в качестве эталона, в другую добавляем ацетат натрия. Раствор приобрел жёлтый цвет.
Опыт №3: «Равновесие в растворе слабого основания»
В две пробирки наливаем раствор NH3 и добавляем фенолфталеин. Раствор приобрёл малиновый цвет. Одну пробирку оставляем в качестве эталона, в другую добавляем хлорид аммония. Пробирка с хлоридом приобрела более светлый цвет.
Опыт №4
Смешиваем в пробирке хлорид стронция и сульфит кальция. Выпадает осадок и раствор мутнеет. В другую пробирку наливаем хлорид кальция и сульфат стронция – изменений нет.
Опыт №6
В шесть пробирок наливаем раствор лакмуса. В пробирки поочерёдно наливаем карбонат калия,, фосфат натрия, хлорид натрия, хлорид аммония, ацетат аммония. В первой пробирке раствор посветлел. Во второй выпал осадок, в третьей и пятой - без изменений, в четвёртой раствор стал бледно-фиолетовым.
