
- •Теоретична частина
- •Експериментальна частина Усі досліди проводити у витяжній шафі Дослід 1. Відношення бензолу та скипідару до бромної води
- •Дослід виконувати у витяжній шафі у захисних окулярах!
- •Дослід 3. Відношення бензолу та скипідару до розчину перманганату калію
- •Техніка безпеки
- •Контрольні запитання та завдання
- •Завдання для самостійної роботи
- •Лабораторна робота 3 Тема: Хімічні властивості фенолів
- •Теоретична частина
- •Експериментальна частина
- •Техніка безпеки
- •Контрольні запитання та завдання
- •Завдання до самостійної роботи
- •Лабораторна робота 4 Тема: Ароматичні аміни Мета роботи: Вивчити хімічні властивості ароматичних амінів, провести відповідні хімічні досліди, якісні реакції.
- •Теоретична частина
- •Експериментальна частина
- •Техніка безпеки
- •Контрольні запитання та завдання
- •Завдання для самостійної роботи
- •Лабораторна робота 5 Тема: Діазо- і азосполуки
- •Теоретична частина
- •Експериментальна частина
- •Техніка безпеки
- •Контрольні запитання та завдання
- •Завдання для самостійної роботи
- •Теоретична частина
- •Експериментальна частина
- •Техніка безпеки
- •Контрольні запитання та завдання
- •Завдання для самостійної роботи
- •Лабораторна робота 7 Тема: Хімічні властивості ароматичних карбонових кислот Мета роботи: Вивчити хімічні властивості ароматичних карбонових кислот, провести відповідні хімічні досліди.
- •Теоретична частина
- •Експериментальна частина
- •Техніка безпеки
- •Контрольні запитання та завдання
- •Завдання для самостійної роботи
- •Лабораторна робота 9 Тема: Хімічні властивості гетероциклів ?
- •Література
Контрольні запитання та завдання
Напишіть рівняння реакції срібного дзеркала для фенілоцтового альдегіду.
Які карбонільні сполуки реагують з фуксинсульфітною кислотою?
Наведіть рівняння реакції утворення гідросульфітного похідного для бензальдегіду.
Наведіть рівняння реакції утворення оксиму та фенілгідразону ацетофенону.
Наведіть механізм та рівняння реакції Канніццаро для бензальдегіду.
Наведіть механізм взаємодії бензальдегіду з KCN.
Завдання для самостійної роботи
Здійсніть перетворення:

Перетворити в декілька стадій:
Бензен ацетофенон.
Бензен 2-нітробензальдегід.
Ацетилен 2,4-дннітробензальдегід.
Метан бензоїн.
Бензен цннамоновий альдегід.
Бензальдегід цннамонова кислота.
Толуен мигдальна кислота.
Виконати завдання:
[2], № 4.30, 42-46, 75-77, 79-82.
Лабораторна робота 7 Тема: Хімічні властивості ароматичних карбонових кислот Мета роботи: Вивчити хімічні властивості ароматичних карбонових кислот, провести відповідні хімічні досліди.
Тривалість виконання: 2 год.
Теоретична частина
Для ароматичних карбонових кислот характерні всі хімічні перетворення за участю карбоксильної групи, які притаманні насиченим аліфатичним кислотам, та реакції електрофільного заміщення в бензольному ядрі.
Реакції карбоксильної групи відбуваються як з розривом О-Н зв,язку (кислотні властивості), так і С-О зв,язку (утворення похідних карбонових кислот). Розподіл електронної густини визначається електроноакцепторними властивостями карбоксильної групи. Бензойна кислота сильніша, ніж аліфатичні монокарбонові кислоти, крім мурашиної і a,b-ненасичених кислот. Це свідчить про наявність p-p-спряження бензольного ядра і карбоксильної групи, яке впливає на іонізацію О-Н зв,язку.

Замісники у бензольному ядрі впливають на силу ароматичних кислот, електронодонорні замісники зменшують кислотність, а електроноакцепторні – збільшують. При цьому в карбоксилатному аніоні відсутнє пряме спряження атомів оксигену з будь-яким замісником у бензольному ядрі (на відміну від фенолят-аніона). Відомо, що чим стабільніший такий аніон, тим сильніша кислота. Стабілізація карбоксилат-аніона підвщується в основному завдяки -І-ефекту електроноакцепторних замісників. При розташуванні електронодонорних замісників в о- положенні щодо карбоксильної групи спостерігається аномальне підвищення сили кислоти, що може бути пояснене утворенням внутрішньомолекулярного водневого зв,язку, який сприяє іонізації кислоти. Існування водневого зв,язку між карбоксильним оксигеном або карбоксилат-аніоном і замісником найхарактерніше для гідроксикарбонових кислот на зразок саліцилової:
|
або |
|
Крім того, на силу ароматичних кислот впливає природа розчинника. Розчинники характеризуються певними основними або кислотними властивостями. Це впливає на процес сольватації карбоксильної групи.
В реакціях електрофільного заміщення в бензольному ядрі (галогенування, нітрування тощо) карбоксильна група як електроноакцепторний замісник орієнтує електрофіл переважно в м-положення [1, c. 726-732].
-

м-нітробензойна кислота


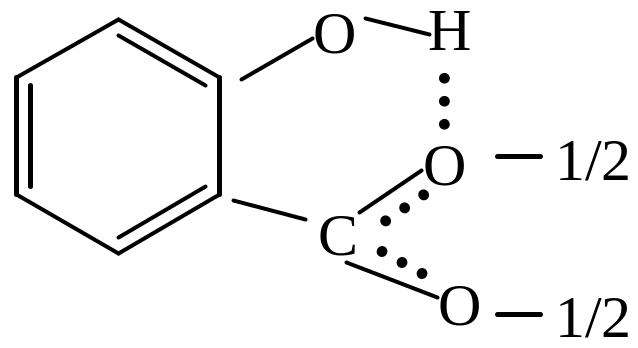 .
.