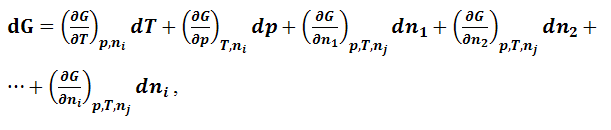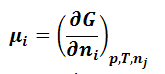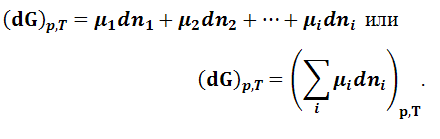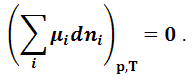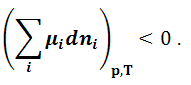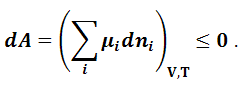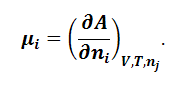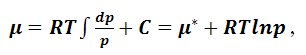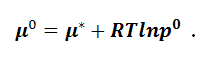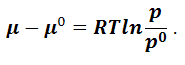- •1.1. Основные понятия и определения химической термодинамики
- •1.2. Первый закон термодинамики
- •1.3. Закон Гесса. Тепловой эффект химической реакции
- •1.4. Зависимость теплового эффекта реакции от температуры. Уравнения Кирхгоффа
- •1.5. Второй закон термодинамики. Энтропия
- •1.6. Изменение энтропии в различных процессах
- •1.7. Третий закон термодинамики. Абсолютное значение энтропии
- •1.8. Энергии Гиббса и Гельмгольца. Характеристические функции
- •1.9. Условия равновесия в системе с переменным количеством компонентов. Химический потенциал
1.9. Условия равновесия в системе с переменным количеством компонентов. Химический потенциал
При протекании многих процессов количества веществ в системе изменяются. Это происходит, например, при фазовых превращениях или в химических реакциях. В таких процессах термодинамические потенциалы (энергии Гиббса или Гельмгольца) представляют собой функции не только температуры, давления или объема, но и количества веществ:
|
|
(1.9.1) |
где n1, n2,…ni – количества компонентов в системе. Полный дифференциал функции (1.9.1) через частные производные можно выразить в виде следующей суммы:
|
|
(1.9.2) |
где индекс ni при частных производных означает постоянное количество всех компонентов, а nj - постоянное количество всех компонентов, кроме того, изменение которого рассматривается. Частные производные энергии Гиббса по количествам компонентов в уравнении (1.9.2) называют химическими потенциалами:
|
|
(1.9.3) |
- химический потенциал i–го компонента. Из последнего выражения следует, что химический потенциал i-го компонента равен приращению энергии Гиббса при добавлении одного моль этого компонента к большому объему системы при постоянных температуре и давлении. Термин «большой объем системы» означает, что состав системы практически не изменяется после добавления одного моль компонента. При постоянных давлении и температуре два первых слагаемых в уравнении (1.9.2) обращаются в нуль. Поэтому получаем:
|
|
(1.9.31) |
Так как при равновесии (dG)p,T = 0, то условием равновесия в системе с переменным количеством компонентов будет:
|
|
(1.9.4) |
Условие самопроизвольного протекания процесса:
|
|
(1.9.5) |
Для других термодинамических потенциалов (A, U, H) аналогично можно получить условия самопроизвольного протекания процесса и равновесия при соответствующих постоянных условиях. Так, например, для энергии Гельмгольца:
|
|
(1.9.6) |
При этом химический потенциал определяется как частная производная энергии Гельмгольца по количеству компонента:
|
|
(1.9.7) |
Для того чтобы получить взаимосвязь химического потенциала с параметрами состояния воспользуемся уравнением (1.8.13). При постоянной температуре оно будет иметь вид:
|
|
(1.9.8) |
Для одного моль вещества:
|
|
(1.9.9) |
После интегрирования уравнения (1.9.9) будем иметь:
|
|
(1.9.10) |
где C – постоянная интегрирования, не зависящая от давления, но зависящая от температуры. Чтобы избавиться от интеграла в уравнении (1.9.10), необходимо знать зависимость между объемом и давлением при постоянной температуре. Для одного моль идеального газа эта зависимость определяется уравнением состояния: V = RT/p. После подстановки в (1.9.10) получим:
|
|
(1.9.11) |
где μ* - новая постоянная интегрирования. При р =1 μ = μ*=μ0, где μ0 - стандартный химический потенциал. При этом за стандартное состояние принимают состояние газа, в котором его давление равно 1 атм, а температура – 298,15 К. В системе SI стандартное давление равно р0 = 1,013•105 Па, и стандартный химический потенциал будет равен:
|
|
(1.9.12) |
Вычтем уравнение (1.9.12) из (1.9.11):
|
|
(1.9.13) |
Обозначим
– относительное давление, тогда уравнение (1.9.13) запишется следующим образом:
|
|
(1.9.14) |
Последнее уравнение справедливо для расчета химического потенциала одного моль идеального газа, если давление выражать в любых единицах измерения. При этом стандартное давление p0 необходимо выразить в тех же самых единицах. Данное уравнение справедливо также для расчета химического потенциала компонента идеальной газовой смеси, так как компоненты в идеальной газовой смеси между собой не взаимодействуют, и общий объем равен сумме объемов отдельных газов, а общее давление – сумме парциальных давлений. Для каждого i-го компонента можно записать уравнение:
|
|
(1.9.15) |
Химический потенциал неидеального газа можно вычислить двумя способами. Первый состоит в том, что для решения уравнения (1.9.10) объем газа выражают через давление, используя одно из уравнений неидеального газа. При этом получаются громоздкие уравнения, содержащие большое количество постоянных, которые определяются опытным путем. Другой способ предложил в 1901 году американский ученый Льюис. В этом способе используются те же выражения, что и для идеального газа, но вместо давления в них подставляют переменную f, называемую летучестью. Летучесть определяют экспериментальным путем различными способами.