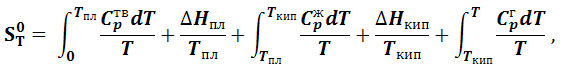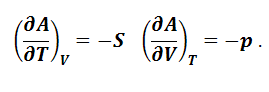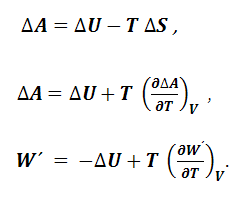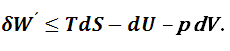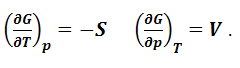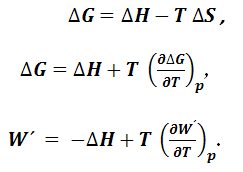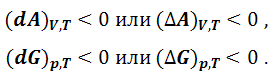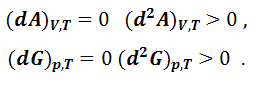- •1.1. Основные понятия и определения химической термодинамики
- •1.2. Первый закон термодинамики
- •1.3. Закон Гесса. Тепловой эффект химической реакции
- •1.4. Зависимость теплового эффекта реакции от температуры. Уравнения Кирхгоффа
- •1.5. Второй закон термодинамики. Энтропия
- •1.6. Изменение энтропии в различных процессах
- •1.7. Третий закон термодинамики. Абсолютное значение энтропии
- •1.8. Энергии Гиббса и Гельмгольца. Характеристические функции
- •1.9. Условия равновесия в системе с переменным количеством компонентов. Химический потенциал
1.7. Третий закон термодинамики. Абсолютное значение энтропии
По приведенным выше уравнениям можно вычислять изменение энтропии в различных процессах, но найти абсолютное значение энтропии не представляется возможным. Однако на основании экспериментальных данных по изменению энтропии химических реакций В.Нернст в 1906 году пришел к выводу, что вблизи абсолютного нуля температур изменение энтропии становится пренебрежимо малым. Позднее М. Планк в 1912 году высказал утверждение, не доказуемое на опыте, что при абсолютном нуле энтропия чистого кристаллического вещества равна нулю. Это утверждение получило название постулата Планка или третьего закона термодинамики и позволило предложить способ вычисления абсолютного значения энтропии для различных веществ. Предположим, что какое-либо вещество при абсолютном нуле находится в виде правильного кристалла и его энтропия равна нулю. Мысленно проведем процесс, постепенно переводя данное вещество в газообразное состояние при произвольно выбранной температуре Т при стандартном давлении. При этом с веществом произойдет ряд фазовых превращений. Общее изменение энтропии будет складываться из суммы изменения энтропий за счет нагревания вещества до температуры фазового перехода (уравнение (1.6.4)) и изменения за счет фазового превращения (уравнение (1.6.2)).
|
|
(1.7.1) |
где Cpтв,Cpж,Cpг – теплоемкости вещества соответственно в твердом, жидком и газообразном состояниях; ΔHпл,ΔHкип – теплоты плавления и кипения соответственно при температурах плавления (Tпл) и кипения (Tкип). Для расчета абсолютного значения энтропии по уравнению (1.7.1) необходимо иметь данные по зависимостям теплоемкостей вещества в различных агрегатных состояниях от температуры. Если в твердом состоянии вещество переходит из одной кристаллической модификации в другую, то необходимо учитывать изменение энтропии этого процесса.
1.8. Энергии Гиббса и Гельмгольца. Характеристические функции
На основании математических выражений первого и второго законов термодинамики можно получить следующее объединенное выражение:
|
|
(1.8.1) |
В уравнении (1.8.1) знак равенства справедлив для равновесных, а неравенства – для неравновесных процессов. Рассмотрим термодинамический процесс, протекающий при постоянных температуре и объеме. Из уравнения (1.8.1) выразим величину полезной работы с учетом того, что dV=0:
|
|
(1.8.2) |
Величина U – TS = A (1.8.3) получила название энергии Гельмгольца, поэтому из уравнения (1.8.1) следует, что
|
|
(1.8.4) |
Уравнение (1.8.4) свидетельствует о том, что полезная работа при постоянных температуре и объеме совершается за счет убыли энергии Гельмгольца. Если продифференцировать уравнение (1.8.3), то получим выражение:
|
|
(1.8.5) |
При подстановке величины dU, выраженной из уравнения (1.6.7), в уравнение (1.8.5), получаем:
|
|
(1.8.6) |
На основании свойств полного дифференциала можно записать:
|
|
(1.8.7) |
Таким образом, с помощью производных энергии Гельмгольца можно выразить термодинамические свойства системы – энтропию и давление. Энтропия является мерой убыли энергии Гельмгольца с увеличением температуры при постоянном объеме, а давление – мерой убыли энергии Гельмгольца с возрастанием объема при постоянной температуре. Подобного рода функции состояния системы, посредством которых и их производных могут быть выражены в явном виде все термодинамические свойства системы, называются характеристическими функциями. Из уравнений (1.8.2), (1.8.3), (1.8.7) следует, что для равновесного процесса, протекающего при постоянных объеме и температуре, справедливы следующие уравнения, называемые уравнениями Гиббса-Гельмгольца:
|
|
(1.8.8) |
Рассмотрим термодинамический процесс, протекающий при постоянных температуре и давлении. Из уравнения (1.8.1) выразим величину полезной работы:
|
|
(1.8.9) |
Величина U + pV– TS = A + pV = H – TS = G (1.8.10) получила название энергии Гиббса, поэтому из уравнения (1.8.1) следует, что
|
|
(1.8.11) |
Уравнение (1.8.11) свидетельствует о том, что полезная работа при постоянных температуре и давлении совершается за счет убыли энергии Гиббса. Если продифференцировать уравнение (1.8.10), то получим выражение:
|
|
(1.8.12) |
После подстановки dA из уравнения (1.8.6) получим следующее выражение:
|
|
(1.8.13) |
Из последнего выражения следует, что энергия Гиббса является явной и характеристической функцией давления и температуры:
|
|
(1.8.14) |
Объем системы – мера возрастания энергии Гиббса с возрастанием давления при постоянной температуре, а энтропия – мера убыли энергии Гиббса с возрастанием температуры при постоянном давлении. Для равновесного процесса, протекающего при постоянных давлении и температуре, можно записать уравнения Гиббса-Гельмгольца в виде:
|
|
(1.8.15) |
Если в изолированной системе критерием направленности самопроизвольного процесса и равновесия является изменение энтропии, то в закрытых системах – величина полезной работы. Действительно, при осуществлении любого процесса полезная работа является положительной. Максимальная полезная работа приобретает свойство функции состояния при следующих условиях:
|
|
(1.8.16) |
Cледовательно, при самопроизвольном протекании процесса в закрытой системе термодинамические потенциалы – энергии Гиббса и Гельмгольца – при постоянстве соответствующих параметров должны уменьшаться, а при достижении равновесия – достигать минимальной величины. Таким образом, критериями самопроизвольного протекания процессов в реальных системах являются неравенства:
|
|
(1.8.17) |
Критерии равновесия:
|
|