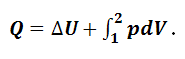- •1.1. Основные понятия и определения химической термодинамики
- •1.2. Первый закон термодинамики
- •1.3. Закон Гесса. Тепловой эффект химической реакции
- •1.4. Зависимость теплового эффекта реакции от температуры. Уравнения Кирхгоффа
- •1.5. Второй закон термодинамики. Энтропия
- •1.6. Изменение энтропии в различных процессах
- •1.7. Третий закон термодинамики. Абсолютное значение энтропии
- •1.8. Энергии Гиббса и Гельмгольца. Характеристические функции
- •1.9. Условия равновесия в системе с переменным количеством компонентов. Химический потенциал
1.3. Закон Гесса. Тепловой эффект химической реакции
Раздел химической термодинамики, в котором изучаются процессы, связанные с поглощением или выделением тепла, называется термохимией. Тепловые эффекты необходимы для расчетов тепловых балансов и для исследования химического равновесия. Предположим, что в идеальной газовой смеси протекает химическая реакция согласно стехиометрическому уравнению:
|
|
(1.3.1) |
Если в результате реакции прореагируют исходные вещества и получатся продукты реакции в стехиометрических количествах (ν1, ν2, ν3, ν4, - стехиометрические коэффициенты), то говорят, что реакция совершила один пробег. При отсутствии других видов работ, кроме работы расширения, можно найти выражение для расчета теплоты, проинтегрировав уравнение (1.2.3):
|
|
(1.3.2) |
При V = const QV = ΔU; при p = const Qp = ΔU+pΔV=ΔH. Для химической реакции теплоты Qp и QV – тепловые эффекты при постоянных давлении и объеме соответственно. Тепловым эффектом химической реакции называют количество теплоты, которое выделяется (поглощается) при следующих условиях: - реакция совершает один пробег; - давление или объем постоянны; - все другие виды работ, кроме работы расширения, отсутствуют; - продукты реакции имеют ту же температуру, что и исходные вещества. Так как внутренняя энергия и энтальпия являются функциями состояния, то тепловой эффект химической реакции не зависит от пути процесса (промежуточных стадий), а определяется только начальным и конечным состояниями системы (закон Гесса). Найдем разность:
|
Qp - QV = ΔU + pΔV - ΔU = pΔV |
(1.3.3) |
Для идеальной газовой смеси
|
pΔV = ΔνRT |
(1.3.4) |
где Δν = (ν3 + ν4) – (ν1 + ν2 ).
|
Qp - QV = ΔνRT |
(1.3.5) |
Уравнение (1.3.5) устанавливает связь между тепловыми эффектами при постоянном давлении и объеме. Его можно использовать и для реальных систем при небольших давлениях. Если в реакции участвуют вещества в конденсированном состоянии, то при расчете Δν их стехиометрические коэффициенты не учитывают. Например, для реакции:
С6H6(ж) + 7,5O2 = 6CO2 + 3H2O(ж) Δν = 6 - 7,5 = -1,5
Для экзотермической реакции тепловой эффект считается отрицательным (Δr H <0), так как энергия (теплота) выделяется из системы, для эндотермической реакции тепловой эффект положителен (Δr H >0), так как энергия (теплота) поглощается из окружающей среды. Закон Гесса дает возможность рассчитывать тепловые эффекты, сопровождающие химические превращения. Для этого в термохимии введены понятия теплот образования и сгорания. Под теплотой образования химического соединения понимают тепловой эффект реакции образования 1 моль этого вещества из простых веществ, взятых в устойчивом состоянии при рассматриваемых условиях. Под теплотой сгорания химического соединения понимают тепловой эффект реакции полного сгорания 1 моль этого вещества с образованием продуктов определенного состава. Продуктами сгорания являются CO2, Н2О(ж), N2, SO2, HCl и т.д. В справочной литературе приводятся значения теплот образования и сгорания при стандартных условиях: Т = 298,15 К и p = 1 атм, обозначения которых ΔfH2980 и Δс H2980 соответственно. Расчеты тепловых эффектов возможны на основании следствий из закона Гесса. Тепловой эффект реакции равен алгебраической сумме теплот образования продуктов реакции за вычетом алгебраической суммы теплот образования исходных веществ (с учетом стехиометрических коэффициентов). Тепловой эффект реакции равен алгебраической сумме теплот сгорания исходных веществ за вычетом алгебраической суммы теплот сгорания продуктов реакции (с учетом стехиометрических коэффициентов). Для реакции (1.3.1) стандартный тепловой эффект вычисляется по уравнениям:
|
Δr H2980 = [ν3Δf H2980 (A3 ) + ν4Δf H2980 (A4 )] - [ν1Δf H2980 (A1 ) + ν2Δf H2980 (A2 )] |
(1.3.6) |
|
Δr H2980 = [ν1Δc H2980 (A1 ) + ν2Δc H2980 (A2 )] - [ν3Δc H2980 (A3 ) + ν4Δc H2980 (A4 )] |