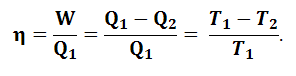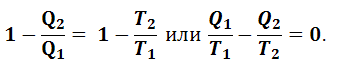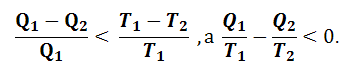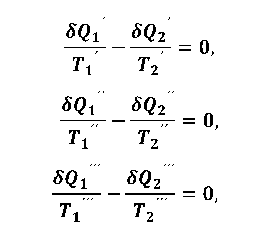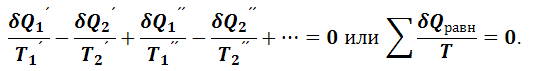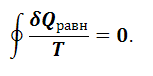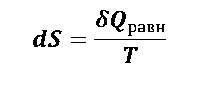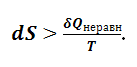- •1.1. Основные понятия и определения химической термодинамики
- •1.2. Первый закон термодинамики
- •1.3. Закон Гесса. Тепловой эффект химической реакции
- •1.4. Зависимость теплового эффекта реакции от температуры. Уравнения Кирхгоффа
- •1.5. Второй закон термодинамики. Энтропия
- •1.6. Изменение энтропии в различных процессах
- •1.7. Третий закон термодинамики. Абсолютное значение энтропии
- •1.8. Энергии Гиббса и Гельмгольца. Характеристические функции
- •1.9. Условия равновесия в системе с переменным количеством компонентов. Химический потенциал
1.5. Второй закон термодинамики. Энтропия
Первый закон термодинамики позволяет составлять энергетические балансы термодинамических процессов, но не позволяет судить о возможности или невозможности того или иного процесса. Для этого используют второй закон термодинамики, который, так же, как и первый, является постулатом, и применим для макросистем. Имеются различные формулировки данного закона, которые являются эквивалентными, либо следуют одна из другой. В формулировке, предложенной Кельвином и Планком, «невозможна периодически действующая тепловая машина, единственным результатом действия которой было бы получение работы за счет отнятия теплоты от теплового резервуара». Условно схему теплового двигателя можно представить в виде, изображенном на рис.2. Возвратно-поступательное движение поршня в цилиндре возможно только в том случае, если происходит периодический процесс, включающий расширение и сжатие рабочего тела. При поглощении тепла Q1, поступающего от теплоисточника, рабочее тело расширяется, при отдаче тепла Q2 теплоприемнику – сжимается. Таким образом, в механическую работу переходит разность теплот:
|
W = Q1 - Q2 |
(1.5.1) |
Необходимо отметить, что соотношение (1.5.1) относится лишь к периодическому (циклическому) процессу. При однократном расширении рабочего тела возможен полный переход работы в теплоту, например, при изотермическом расширении идеального газа. Если тепловая машина работает без трения и теплопотерь в окружающую среду, то коэффициент полезного действия такой машины будет равен
|
|
(1.5.2) |
Цикл идеальной тепловой машины состоит из двух изотерм (AB и CD) и двух адиабат (BC и DA) (рис.3) (цикл Карно). При рассмотрении данного цикла можно показать, что коэффициент полезного действия идеальной тепловой машины определяется только разностью температур теплоисточника (Т1) и теплоприемника (Т2) и равен
|
|
(1.5.3) |
Уравнение (1.5.3) можно представить в виде
|
|
(1.5.4) |
Можно показать, что к.п.д. цикла Карно, состоящего из обратимых равновесных процессов, больше к.п.д. любого другого кругового цикла, состоящего из неравновесных процессов, имеющих теплопотери и потери на трение, то есть для неравновесного цикла
|
|
(1.5.5) |
Любой произвольно взятый цикл можно разбить на большое количество бесконечно малых циклов Карно с помощью изотерм и адиабат. Для бесконечно малых циклов можно записать систему уравнений
|
|
(1.5.6) |
................................
Суммируя равенства (1.5.6), получим следующее уравнение
|
|
(1.5.7) |
В пределе алгебраическая сумма (1.5.7) переходит в интеграл, взятый по замкнутому контуру:
|
|
(1.5.8) |
Из высшей математики известно, что если интеграл, взятый по замкнутому контуру, равен нулю, то существует функция состояния, полный дифференциал которой равен подынтегральной величине:
|
|
(1.5.9) |
Эта функция (S) получила название энтропия. Уравнение (1.5.9) является математическим выражением второго закона термодинамики для равновесных процессов. Для неравновесных процессов из уравнения (1.5.5) следует, что
|
|
(1.5.10) |
Уравнение (1.5.10) является математической записью второго закона термодинамики для неравновесных процессов. Если неравновесный процесс протекает в изолированной системе, то δQ = 0, U = const, V = const, и из уравнения (1.5.10) следует, что
|
(dS)U,V > 0 или (ΔS)U,V > 0. |
(1.5.11) |
Когда в результате неравновесного процесса изолированная система придет в состояние равновесия, то энтропия ее достигнет максимума, и условиями равновесия в соответствии с уравнением (1.5.9) будут:
|
(dS)U,V = 0; (d2 S)U,V = 0; (ΔS)U,V = 0 |
(1.5.12) |
Таким образом, изменение энтропии может служить критерием направленности и равновесия термодинамических процессов в изолированной системе.