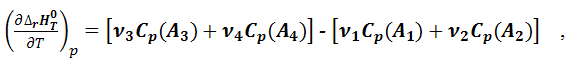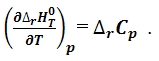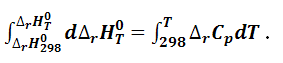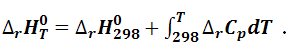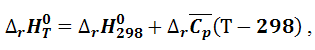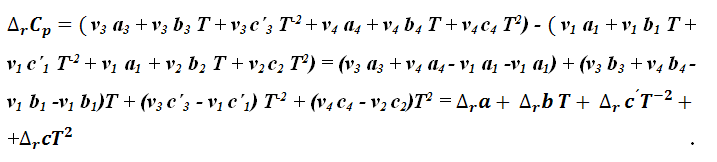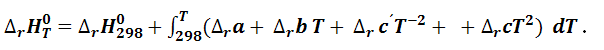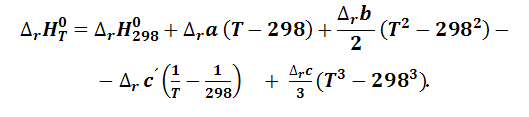- •1.1. Основные понятия и определения химической термодинамики
- •1.2. Первый закон термодинамики
- •1.3. Закон Гесса. Тепловой эффект химической реакции
- •1.4. Зависимость теплового эффекта реакции от температуры. Уравнения Кирхгоффа
- •1.5. Второй закон термодинамики. Энтропия
- •1.6. Изменение энтропии в различных процессах
- •1.7. Третий закон термодинамики. Абсолютное значение энтропии
- •1.8. Энергии Гиббса и Гельмгольца. Характеристические функции
- •1.9. Условия равновесия в системе с переменным количеством компонентов. Химический потенциал
1.4. Зависимость теплового эффекта реакции от температуры. Уравнения Кирхгоффа
На основании следствий из закона Гесса возможен расчет тепловых эффектов при той температуре, для которой заданы теплоты образования (сгорания) веществ – участников реакции, обычно это стандартная температура 298,15 К. Однако часто возникает необходимость расчета тепловых эффектов при других температурах. Для этого используют зависимость теплоемкости вещества от температуры. Под средней теплоемкостью в интервале температур понимают отношение конечного количества теплоты, затраченного на нагревание единицы массы (или количества) вещества, к разности температур. Истинная теплоемкость – отношение бесконечно малого количества теплоты к бесконечно малому приращению температуры. Различают удельную (отнесенную к 1 кг) и молярную (отнесенную к 1 моль) теплоемкости. В зависимости от условий определения различают теплоемкость при постоянном давлении (Ср) и постоянном объеме (Сv). Так как количество теплоты при постоянном объеме равно изменению внутренней энергии, а при постоянном давлении – изменению энтальпии, то истинные теплоемкости равны:
|
|
(1.4.1) |
Для расчетов необходимо знать значения теплоемкостей при различных температурах. Теоретические расчеты теплоемкости для реальных веществ дают только приближенные значения, поэтому зачастую теплоемкости определяют экспериментально и представляют их зависимости от температуры в виде интерполяционных степенных уравнений вида:
|
Ср = a + bT + c'T-2 – для неорганических веществ |
(1.4.2) |
|
Ср = a + bT + cT2 – для органических веществ |
(1.4.3) |
Обозначим энтальпии веществ, принимающих участие в реакции (1.3.1), через HA1, HA2,HA3,HA4. Тогда общее изменение энтальпии при заданной температуре Т будет равно:
|
Δr HT0 = (ν3 HA3 + ν4HA4) - (ν1 HA1 + ν2HA2) |
(1.4.4) |
Продифференцируем уравнение (1.4.4) по температуре при постоянном давлении:
|
|
(1.4.5) |
С учетом уравнения (1.4.1):
|
|
(1.4.6) |
или температурный коэффициент теплового эффекта химической реакции при постоянном давлении равен изменению изобарной теплоемкости реагирующих веществ:
|
|
(1.4.7) |
Аналогичным образом можно получить уравнение для температурного коэффициента теплового эффекта реакции при постоянном объеме:
|
|
(1.4.8) |
Уравнения (1.4.7) и (1.4.8) называются уравнениями Кирхгоффа в дифференциальной форме. В соответствие с данными уравнениями влияние
температуры на тепловой эффект обусловливается знаком величины изменения теплоемкости. При условии Δr Cp>0 температурный коэффициент теплового эффекта положителен, что означает возрастание теплового эффекта с ростом температуры (кривая 1, рис.1). При условии ΔrCp<0 температурный коэффициент теплового эффекта отрицателен, что означает уменьшение теплового эффекта с ростом температуры (кривая 2, рис.1). Тепловой эффект реакции не зависит от температуры (прямая 3, рис.1) при условии ΔrCp=0. Уравнение Кирхгоффа дает возможность вычислить тепловой эффект при любой заданной температуре. Для этого уравнение необходимо проинтегрировать. Ввиду того, что при небольших давлениях тепловой эффект практически не зависит от давления, частную производную в выражении (1.4.7) можно заменить на полную и разделить переменные:
|
dΔr HT0 = Δr Cp dT |
(1.4.9) |
Проинтегрируем уравнение (1.4.9), выбрав в качестве нижнего предела температуры стандартную 298 К, для которой легко вычислить тепловой эффект:
|
|
(1.4.10) |
После интегрирования получаем выражение для расчета теплового эффекта:
|
|
(1.4.11) |
Если известны средние теплоемкости веществ – участников реакции в интервале температур от 298 К до Т, то после интегрирования уравнения (1.4.11) получим выражение:
|
|
(1.4.12) |
в котором для вычисления изменения теплоемкости необходимо найти в справочных таблицах их средние значения для всех веществ и применить следующее уравнение (для реакции вида 1.3.1):
|
|
(1.4.13) |
Для более точного расчета теплового эффекта необходимо использовать зависимости теплоемкостей веществ от температуры, заданные в виде степенных уравнений. Допустим, что для веществ А1 и А3 реакции (1.3.1) температурная зависимость имеет вид уравнения (1.4.2), а для веществ А2 и А4 – уравнения (1.4.3), тогда уравнение для изменения теплоемкости будет иметь вид (опускаем для простоты индекс А у постоянных температурных зависимостей):
|
|
(1.4.14) |
Подставим выражение для изменения теплоемкости (1.4.14) в уравнение (1.4.11), получим:
|
|
(1.4.15) |
После интегрирования уравнения (1.4.15) получим интегральную форму уравнения Кирхгоффа для расчета теплового эффекта
|
|
(1.4.16 |