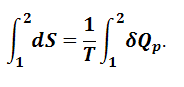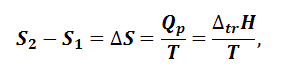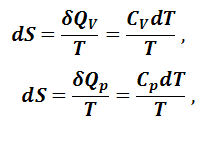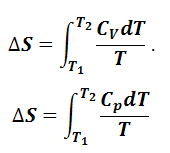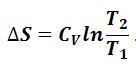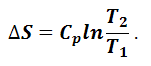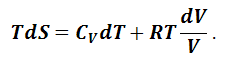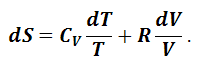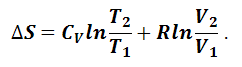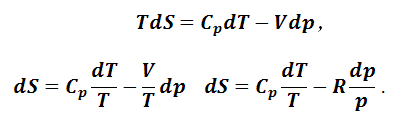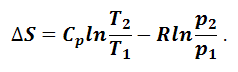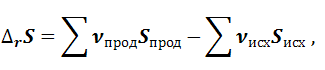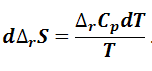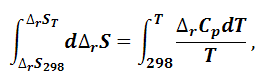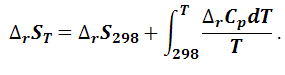- •1.1. Основные понятия и определения химической термодинамики
- •1.2. Первый закон термодинамики
- •1.3. Закон Гесса. Тепловой эффект химической реакции
- •1.4. Зависимость теплового эффекта реакции от температуры. Уравнения Кирхгоффа
- •1.5. Второй закон термодинамики. Энтропия
- •1.6. Изменение энтропии в различных процессах
- •1.7. Третий закон термодинамики. Абсолютное значение энтропии
- •1.8. Энергии Гиббса и Гельмгольца. Характеристические функции
- •1.9. Условия равновесия в системе с переменным количеством компонентов. Химический потенциал
1.6. Изменение энтропии в различных процессах
Для необратимых процессов изменение энтропии связано с теплотой в виде неравенств. Поэтому по данным для необратимых процессов изменение энтропии вычислить нельзя. Но так как энтропия является функцией состояния, то ее изменение в реальном процессе можно вычислить, мысленно разбив процесс на стадии, которые происходят обратимо. Для последних необходимо провести расчет по соответствующим уравнениям, а затем все изменения энтропий просуммировать. Рассмотрим вычисление изменения энтропии для ряда обратимых процессов. 1.Изменение энтропии при фазовых переходах. Фазовые равновесные превращения первого рода – переходы одной кристаллической модификации вещества в другую, плавление, возгонка, испарение протекают при постоянных давлении и температуре. Поэтому при расчете изменения энтропии можно воспользоваться математическим выражением второго закона термодинамики для равновесного процесса (1.5.9). Проинтегрируем его:
|
|
(1.6.1) |
|
|
(1.6.2) |
где Δtr H – изменение энтальпии при фазовом переходе. 2. Изменение энтропии при нагревании (охлаждении) системы. При нагревании (охлаждении) любой системы от температуры Т1 до температуры Т2 при постоянном объеме δQV = dU = CVdT, а при постоянном объеме δQp = dН = CpdT, поэтому
|
|
(1.6.3) |
|
|
(1.6.4) |
Если полагать, что теплоемкость не зависит от температуры, то после интегрирования получим следующее уравнение:
|
|
(1.6.5) |
Аналогично можно получить уравнение для расчета изменения энтропии при постоянном давлении:
|
|
(1.6.6) |
3. Изменение энтропии для различных процессов с идеальным газом Запишем объединенное выражение первого и второго законов термодинамики. Для этого выразим δQр из уравнения (1.5.9) и подставим в выражение (1.2.3). Получаем
|
|
(1.6.7) |
Если в системе имеется 1 моль идеального газа при постоянном давлении, то уравнение (1.6.7) можно записать в виде:
|
|
(1.6.8) |
Разделив обе части уравнения (1.6.8) на Т, получим
|
|
(1.6.9) |
Если CV не зависит от температуры, то после интегрирования получаем следующее уравнение для расчета изменения энтропии:
|
|
(1.6.10) |
Если в системе имеется 1 моль идеального газа при постоянном объеме, то преобразуем уравнение (1.6.7), выразив dU через dH. Из определения энтальпии следует, что Н = U+pV, а U=H-pV. Дифференцируем последнее выражение и подставляем в (1.6.7). Получим
|
|
(1.6.11) |
Выражаем dH через изобарную теплоемкость, получаем для 1 моль идеального газа:
|
|
(1.6.12) |
После интегрирования последнего уравнение при условии независимости теплоемкости от температуры получим
|
|
(1.6.13) |
4.Изменение энтропии при протекании химической реакции Если реакция совершает один пробег при постоянных температуре и давлении, то изменение энтропии может быть рассчитано как для функции состояния:
|
|
(1.6.14) |
где ν – стехиометрические коэффициенты, S – мольные энтропии реагентов, значения которых можно найти в таблицах для стандартных условий. Для того чтобы получить уравнение для расчета изменения энтропии для произвольно выбранной температуры и постоянном давлении, необходимо исходить из уравнения второго закона термодинамики, преобразовав его следующим образом:
|
|
(1.6.15) |
Для одного пробега, совершаемого реакцией,
|
|
(1.6.16) |
Интегрируем уравнение (1.6.16):
|
|
(1.6.17) |
|
|
(1.6.18) |
Величину ΔrS298 в уравнении (1.6.18) вычисляют по уравнению (1.6.14) с использованием стандартных энтропий веществ, принимающих участие в химической реакции. ΔrCp можно выразить как функцию температуры,использовав температурные ряды теплоемкости, по уравнению (1.4.14).