
- •Поверхностные явления
- •Жидкость Газ
- •Определение параметрв пав
- •Смачивание флотация
- •Критерии гидрофильности
- •Дисперсные системы
- •Классификация коллоидных систем по агрегатному состоянию дисперсной фазы и дисперсионной среды
- •Классификация по наличию взаимодействия между частицами дисперсной фазы
- •Строение коллоидных частиц
- •Электрохимический или дзета-потенциал
- •Химическая конденсация:
- •Коллоидная защита
- •Седиментационный анализ
- •Эмульсии
- •Электрокинетические явления
- •Электролиз
- •Обратные явления
- •Оптические свойства коллоидных систем
- •Термофорез. Термопреципитация.
- •Размеры вмс
- •Коллиат св-во вмс
- •Мембранное равновесие Доннана
- •Калий-Натриевый насос
Определение параметрв пав
Приведём уравнение Ленгмюра к виду прямой, для этого найдём величину
(имея данные величины можем рассчитывать параметры ПАВ) |
|
Зная предельную адсорбцию можем вывчислить параметры адсорбционного слоя! |
|
Толщина слоя
– длина одной молекулы L= ,
где М- молекул масса, d
–плотность в-ва
,
где М- молекул масса, d
–плотность в-ва
Площадь,
занимаемая одной молекулой ПАВв
насыщенном мономолекулярном слое =
=
Рассмотрим ПАВ
какой-либо жидкости, его поведение. При
переходе молекулы ПАВ на границу раздела
поверхности натяжение изменяется на
величину Δδ. Если площадь поверхности
раздела S, то убыль свободной
поверхностной энергии G
ΔG= Δδ∙S на
каждой единице поверхности возникает
избыток молей вещества Г. Если смотреть
на всю поверхность разделаГ δ. Поэтому
концентрация ПАВ в объёме снижается от
С до (С- ΔС). Работа, необходимая для
такого уменьшения концентрации, составит
А=(-Г)∙S∙R∙T∙ln( ),
т.е. А=(-Г)∙S∙R∙T∙ln(1-
),
т.е. А=(-Г)∙S∙R∙T∙ln(1- )
При малых величинах ΔС, ln(1-
)
принимает значение
…
т.к. работа равна убыли свободной энергии:
)
При малых величинах ΔС, ln(1-
)
принимает значение
…
т.к. работа равна убыли свободной энергии:
А=(-Г)∙S∙R∙T∙
Т.к. работа равна убыли свободной энергии
А= -ΔG=- ΔδS
следовательно Г∙S∙R∙T∙
-=
- ΔδS а значит, Г∙R∙T∙
-=
- Δδ, следовательно Г =
 – уравнение Гиббса для величины
адсорбции. Г =
– уравнение Гиббса для величины
адсорбции. Г =
 – в дифференциальной форме.
– в дифференциальной форме.
Смачивание флотация
Смачивание-это поверхностное явление, которое заключается во взаимодействии жидкости с твердым телом или другой жидкостью, при наличии одновременного контакта этих двух фаз с воздухом.
Адгезия – это межмолекулярное взаимодействие конденсированных фаз.
Когезия – это притяжение молекул внутри отдельной фазы.
Если силы адгезии велики, то жидкость, нанесенная на поверхность твёрдой фазы, растекается на ней до тех пор, пока не образуется мономолекулярный слой – это называется полным смачиванием.
Если велики силы когезии, то нанесенная капля сворачивается в сферу. Это будет полное несмачивание.
Критерии гидрофильности

Угол (краевого) смачивания Θ, отсчитывается между твёрдой поверхностью и касательной, проведенной к поверхностикапли, в точке соприкосновения твердых фаз. (0<ϴ<π), отсюда cosϴ>0 для а), и сosϴ<0 для в).
Чем больше теплота смачивания – тем более гидрофильная поверхность
а) >
>
б) < (*)
Критерий Ребиндера – коэффициент гидрофильности – отношение теплоты смачивания водой к теплоте смачивания маслом:
а) K>1
б)K<1
Флотация- явление разделения частиц, основанное на избирательности их смачивания
Пример: белая глина
(каомин)
 ∙
∙ ∙2
∙2 O,
уголь С
O,
уголь С


1)Адсорбция электролитов
2)Правило Панета-Фаянса
3)Ионно-обменная адсорбция. Иониты Уравнение Никольского
Электролиты в растворах диссасоциируют на ионы, которые могут накапливаться на границе раздела «твёрдое тело/жидкость», поэтому адсорбцию электролитов называют ионной. На их адсорбцию воздействует температура: с её ростом адсорбция растёт, поэтому она называется активированной.
Одной из особенностей активированной адсорбции является избирательность, т.е. неравенство адсорбции катиона и аниона. Избирательность ионной адсорбции описывается правилами Панета-Фаянса:
1)на твёрдой поверхности преимущественно адсорбируется тот ион, который имеет общую с этой поверхностью атомную группировку или изоморфную ей (близкую по параметрам).
AgN +KCl→AgCl↓+KN
(т.е. AgN
+KCl→AgCl↓+KN
(т.е. AgN ,
,
 ,
,
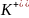 ),
(KCl:
;
),
(KCl:
; ;
)
;
)
2)Если поверхность заряжена, то на неё адсорбируются преимущественно те ионы, которые имеют заряд противоположный заряду поверхности.
3)Если в растворе имеется несколько ионов одинаковой валентности, то адсорбируется преимущественно тот ион, у которого больше радиус кристаллической решётки. (т.к. чем меньше R – тем меньше гидратируется ион, тем меньше его эффективный радиус в растворе и тем легче взаимодействие с поверхностью.
4)Если ионы в растворе различной валентности, то преимущестнно адсорбируются те ионы, заряд которых больше.
Второй особенностью активированной ионной сорбцией является её эквивалентность.
Если на поверхности твердого адсорбента уже адсорбированы ионы какого-либо электролита, то при контакте этого сорбента с другим электролитом, возможен обмен ионами между твердой фазой и средой. Причём происходит он в эквивалентных количествах и подчиняется закону действующих масс.
Иониты (ионно-обменные смолы) – высокопрочные молекулярные нерастворимые соединения, способные набухать в водных растворах и освобождать ионы в процессе диссоциации. Освободившиеся ионы замещаются другими ионами, имеющимися в растворе, с соблюдением эквивалентности и селективности. Природные и синтетические иониты могут быть органического и неорганического происхождения. В своем составе они имеют ионогенные группы, которые определяют функциональные свойства электролитов, поэтому они называются функциональными группами. По функциональным группам иониты делятся на:
1)Катиониты
– они предстваляют собой многоосновные,
нерастворимые кислоты, способные
освобождать и обменивать катион водорода.
Катионы могут находиться в водородной
форме, либо в солевой форме: R=
 -водородная
форма
-водородная
форма
R=
+NaCl↔R- (солевая
форма)+HCl
(солевая
форма)+HCl
2)Аниониты – нерастворимые многоатомные основания, которые высвобождают и обменивают анион гидроксидола.
R-O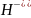 +NaCl↔R-
+NaCl↔R- +NaOH
(гидроксоионная форма ↔ солевая форма)
+NaOH
(гидроксоионная форма ↔ солевая форма)
3)амфолиты – сочетают в себе свойства анионитов и катионитов.
Количественно
ионно-обменная адсорбция описывается
уравнением Никольского. Рассмортим
реакцию обмена ионов
 на ионы
.
С учётом эквивалентности ионный обмен
имеет вид:
на ионы
.
С учётом эквивалентности ионный обмен
имеет вид:
 (ионит)+
(раствор)↔
(ионит)+
(раствор)↔ +
+ (раствор)
(в ионном растворе)
(раствор)
(в ионном растворе)
Константа равновесия
ионного обмена
 на
,
согласно закону действующих масс:
на
,
согласно закону действующих масс:
|
где а – активность ионов растворе
х –количество адсорбированных ионов,
|
Выделим в одну сторону массы, в другую активность:
Количество Адсорбированного иона пропорционально его активности в растворе, т.е. чем сильнее адсорбционные свойства и активность ионов в растворе, тем сильнее он будет поглощаться:
|
Z- заряд ионов
← УРАВНЕНИЕ НИКОЛЬСКОГО
|

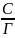 =
= +
+
 tg
угла наклона
tg
угла наклона



