
- •Поверхностные явления
- •Жидкость Газ
- •Определение параметрв пав
- •Смачивание флотация
- •Критерии гидрофильности
- •Дисперсные системы
- •Классификация коллоидных систем по агрегатному состоянию дисперсной фазы и дисперсионной среды
- •Классификация по наличию взаимодействия между частицами дисперсной фазы
- •Строение коллоидных частиц
- •Электрохимический или дзета-потенциал
- •Химическая конденсация:
- •Коллоидная защита
- •Седиментационный анализ
- •Эмульсии
- •Электрокинетические явления
- •Электролиз
- •Обратные явления
- •Оптические свойства коллоидных систем
- •Термофорез. Термопреципитация.
- •Размеры вмс
- •Коллиат св-во вмс
- •Мембранное равновесие Доннана
- •Калий-Натриевый насос
Поверхностные явления
Поверхностное натяжение
Поверхностно-Активные вещества
Адсорбция газов. Уравнение Ленгмюра параметры ПАВ
Адсорбция из растворов. Уравнение Гиббса
Смачивание. Флотация
Жидкость Газ
Молекулы, находящие внутри конденсированной фазы (в глубине), испытывают одинаковое влияние от других частиц со всех сторон. Равнодействующая всех си равна нулю. Молекулы в поверхностном слое окружены подобными себе частицами только внутренней стороны. С внешней же они соприкасаются с частицами другой фазы, притяжение которых существенно меньше. Поэтому равнодействующая всех сил направлена внутрь конденсированной фазы, перпендикулярно поверхности раздела фаз и втягивает молекулу внутрь жидкости. Эта сила называется внутренним давлением и следствием её оказывается поверхностное натяжение жидкости и адсорбция.
σ- поверхностное натяжение
Поверхностное натяжение- это работа по изменению площади поверхности на единицу в обратимом изотермическом процессе: δА= -σ∙dS [Дж/
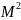 ]
]Поверхностное натяжение – это сила, действующая на единицу границы раздела поверхности и обуславливающая сокращение поверхности. [δ = н/м]
Поверхностное натяжение жидкости неодинаково, зависит от следующих факторов:
а) Межмолекулярное взаимодействие, природа жидкости: чем оно выше – тем больше поверхностное натяжение
б) Температура: повышение температуры снижает поверхностное натяжение
в) наличие растворенных веществ: (по характеру влияния их разделяют на три типа)
-Поверхностно Активные Вещества – уменьшают поверхностно е сопротивление
-Поверхностно Инактивные –увеличивают δ
Поверхностно Индифферентные – не влияют
|
ПАВ обладают в чистом виде малым поверхностным натяжением и малой растворимостью
Их взаимодействие с
молекулами растворителя меньше, чем
взаимодействие между молекулами
растворителя . Т.е.
|
ПИАВ обладают в чистом виде высоким δ и хорошей растворимостью. Их взаимодействие между молекулами растворителя больше, чем взаимодействие между молекулами растворителя, поэтому они стремятся уйти с поверхности растворителя внутрь раствора, чтобы снизить энергетическую насыщенность поверхностного слоя.
Примером ПАВ вещества границы «вода-воздух» является:
а) высшие жирные кислоты
R-(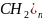 -COOH
-COOH
R-( -COONa (*)
б) высшие амины R-(
-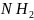
ОН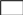
С
О




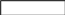
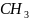 -
-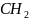 -
-
-
-
(углеводородный радикал)
(карбоксильная группа)
Углеводородный радикал: неполярная часть, нет родства к воде, гидрофобный радикал, родство к маслам, олеофильный радикал
Карбоксил группа: полярная часть, есть родство к воде, гидрофильная группа, нет родства к маслу, олеофобная
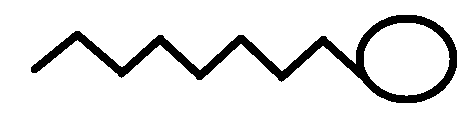
вода уголь
Воздух Вода


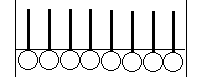

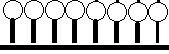
Подобные изменение содержания данного компонента при граничном слое по сравнению с содержанием его во внутренних слоях – называется адсорбцией.
Рассмотрим адсорбцию газов на твёрдых телах. Характерной особенностью этой адсорбций является то, что число мест на которых могут закрепляться молекулы газа является ограниченным.
Ленгмюру принадлежит теория, согласно которой при адсорбции на плоской поверхности может заполняться только один слой, толщиной в одну молекулу – мономолекулярный.
Предположим, что θ – это доля всех, уже занятых центров на поверхности.
(1-θ) Скорость адсорбции должна зависеть от числа ударов молекул газа об поверхность, которая пропорциональна парциальному давлению газа.
При этом вероятность закрепления молекулы пропорциональна доле адсорбционных свободных центров:
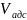 =
=
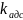 ∙P(1-
θ)
∙P(1-
θ)
∙ - cosnt индекса адсорбции
В результате теплового движения адсорбированныемолекулы могут отрываться от твердой поверхности и возвращаться в газовую фазу. Поэтому скорость десорбции пропорциональна числу таких молекул.
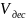 =
=
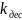 ∙
θ где
k
– const
скорости десорбции
∙
θ где
k
– const
скорости десорбции
При равновесии =
Θ
=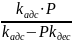
Разделив чилситель
и знаменатель на
и обозначив
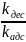 =β, мы получим:
=β, мы получим:
Θ
=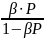 число занятых центров β=
число занятых центров β=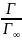 т.е.
=
т.е.
=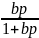
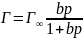 – уравнение
Ленгмюра
– уравнение
Ленгмюра
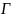 – адсорбция при каком-то давлении
– адсорбция при каком-то давлении
 –
адсорбция предельная
–
адсорбция предельная
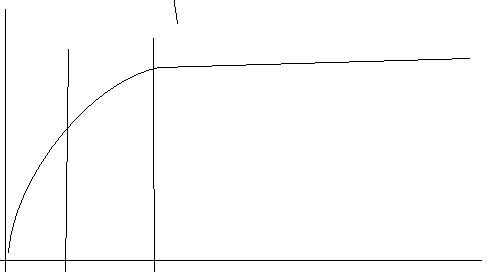 (*)
(*)
1 участок Р1>>Р2 в Р>>1
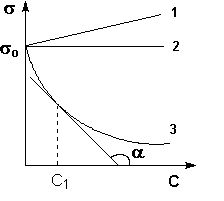
Адсорбция на поверхностных границах хорошо описывается уравнением Фрейндлиха-Бреккера
Г=β∙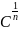 β – величина адсорбции
при равновесной концентрации адсорбтива
при 1моль/литр
β – величина адсорбции
при равновесной концентрации адсорбтива
при 1моль/литр
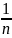 – const, характризуящая
приближение изотермы к прямой (для
газов она составляет величину от 0,2 до
1, для жидкостей от 0,5 до 1
– const, характризуящая
приближение изотермы к прямой (для
газов она составляет величину от 0,2 до
1, для жидкостей от 0,5 до 1

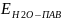 <
<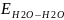 поэтому
молекулы ПАВ выталкиваются в
поверхностный слой и δ раствора
уменьшается.
поэтому
молекулы ПАВ выталкиваются в
поверхностный слой и δ раствора
уменьшается.