
- •Вопрос № 2
- •Вопрос № 3 Двойственная природа электрона. Корпускулярные и волновые свойства электрона. Уравнение де Бройля.
- •Вопрос № 4.
- •Вопрос № 5. Радиоактивный распад, его типы. Закон смещения. Радиоактивность. Виды радиоактивных лучей, их характеристика.
- •Принцип Паули (1925)
- •Емкость n/уровней
- •Способы образования ковалентной связи.
- •Свойства связи.
- •Причины образования химической связи. Основы виды химической связи (ковалентная, ионная, металлическая)
- •Вопрос № 9. Ионная связь и металлическая связь. Ионная связь, ее свойства
- •Свойства связи.
- •Вопрос № 10. Метод валентных связей. Валентность по донорно-акцепторному и обменному механизму.
- •Способы образования ковалентной связи.
- •Донорно-акцепторная связь – разновидность ковалентной связи.
- •Вопрос № 11. Метод молекулярных орбиталей. Его сравнение с методом валентных связей.
- •14. Термодинамические функции:
- •16. Энтропия образования химических соединений.
- •17. Энергия Гиббса образования вещества.
- •18. Обратимые химические реакции. Химическое равновесие. Условия термодинамического равновесия.
- •19. Скорость химических реакций в гомогенных и гетерогенных процессах. Факторы, изменяющие скорость химических реакций.
- •21. Влияние температуры на скорость реакций.
- •Топливный элемент. Принцип работы кислородно-водородного топливного элемента.
- •Основные методы защиты от коррозии. Протекторы, ингибиторы коррозии.
- •Методы получения полимеров. Привести примеры реакций полимеризации и поликонденсации.
Вопрос № 5. Радиоактивный распад, его типы. Закон смещения. Радиоактивность. Виды радиоактивных лучей, их характеристика.
Радиоактивностью было названо явление испускания некоторыми элементами излучения, способного проникать через вещества, ионизировать воздух, вызывать почернение фотографических пластинок.
Открытие радиоактивности 1896 г. Анри Беккерель обнаружил невидимое излучении у урана, которое засвечивает фотопленку без освещения руды 92 U.
Продолжая работу Беккереля супруги Пьер и Мари Кюри в 1892 открыли радиоактивность Ra(радий), Po(полоний), Th(торий).
Естественной радиоактивностью называется процесс сампроизвольного распада ядер природных тяжелых элементов, сопровождающийся выделением лучей высокой проникающей способности и излучением энергии. Оказалось, что все элементы после висмута, начиная с полония естественно радиоактивны.
В 1934 второе поколение Кюри: Фредерик и Жульен открытии явление искусственной радиоактивности для тех изотопов, которые не встречаются в природе, но могут быть получены в результате ядерных процессов.
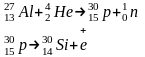
Исследованиями супругов Кюри и английского физика Резерфорда было установлено, что радиоактивное излучение неоднородно: под действием магнитного поля оно разделяется на три пучка, один из которых не изменяет своего первоначального направления, а два других отклоняются в противоположные стороны.
Радиоактивное излучение (естественное изучалось Пьером и Марией Кюри, а также Резерфордом, ими было установлено, что радиоактивное излучение не однородно и в электрическом и магнитном поле разделяется на три пучка α, β, γ.
-
-
лучи – положительно заряженные частицы
+2, масса 4 у.е., ядра
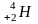 .
Имея большую массу частицы имеют малую
скорость около v=20.000 км/с
и небольшой пробег 8-11см.
.
Имея большую массу частицы имеют малую
скорость около v=20.000 км/с
и небольшой пробег 8-11см.
- β – поток отрицательно заряженных
частиц
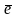 ,
v = 300.000 км/с
,
v = 300.000 км/с
- γ – излучения не имеющее знака заряда короткоовальное магнитное излучение, обладает большой проникающей способностью, т.к. обладает ничтожной массой.
0,005 – 0,4 нм.
Из 39 радиоактивных элементов 4 элемента имеют все виды излучения (α, β ,γ), 21 элемент (α,γ) и 14 элементов (β, γ).
Различают 3 типа радиоактивного распада: α – распад, β – распад и спонтанное деление.
1. α – распад – ядра элементов с порядковым номером 84 и далее неустойчивы. Они стабилизируются путем выделения α – частиц , масса = 4, заряд=+2 (2 p и 2 n) (ядра атома).

Правила смещения 1913 г. Содди и Фаянс сформулированы правила сдвига или смещения при радиоактивном распаде
Дочернее ядро смещается на 2 клетки влево
2. β – распад бывает β- и β+
β- поток электронов, в протонно-дефицитных ядрах происходит переход нейтронов в протоны.

 дочернее
ядро смещается на 1 клетку правее
дочернее
ядро смещается на 1 клетку правее
β+ - в нейтронодефицитных ядрах протон превращается в нейтрон при этом выделяется позитрон


Дочернее ядро сдвигается на одну клетку влево
E- захват
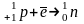
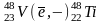
Сдвигается на одну клетку левее
3. Спонтанное деление – самовоспроизвольный распад ядра тяжелых элементов на 2 и более ядра. Никаких правил смещения здесь нет.
Происходит распад исходного ядра на тяжелые и легкие осколки (60:40)
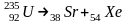
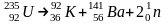
92=38+54
№5
№4
Вопрос № 7.
Квантовые числа, квантовые орбитали. Порядок заполнения электронных структур атомов. Электронная ёмкость s, p, d, f подуровней. В каких группах и подгруппах находятся s, p, d, f элементы, привести примеры.
В 1925 ГОДУ Шледингер предложил уравнение по которому описывается поведение электронов в трехмерном пространстве т.е. по осям x,y,z.

Потенциальная
Полная энергия
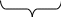
Кинетическая энергия
Решая это уравнение выводят 3 квантовые числа:
n, m, l s эти числа обозначаю поведение электронов в атоме.
n – главное квантовое число. Показывает число энергетических уровней и запас энергии электрона.
n = номеру периода

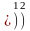
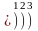
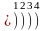 ……………
……………
n 1 2 3 4
l – побочное орбитальное квантовое число показывает число подуровней на уровне
Рассчитывается по формуле
l=n-1
l 0, 0,1 0,1,2 0,1,2,3
Е сли
l=0, l=1 l=2 l=3
сли
l=0, l=1 l=2 l=3

S p d f
m – магнитное квантовое число показывает ориентацию электронного облака в пространстве .
- l через «0» до + l
Когда l=0 -1, 0, +1 -2, - 1, 0, 1, 2 -3, -2, -1, 0, 1, 2, 3



m=0
s p d f
S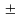 1/2
– спиновое квантовое число показывает
направление вращения электрона вокруг
своей оси.
1/2
– спиновое квантовое число показывает
направление вращения электрона вокруг
своей оси.
