
- •Вопрос № 2
- •Вопрос № 3 Двойственная природа электрона. Корпускулярные и волновые свойства электрона. Уравнение де Бройля.
- •Вопрос № 4.
- •Вопрос № 5. Радиоактивный распад, его типы. Закон смещения. Радиоактивность. Виды радиоактивных лучей, их характеристика.
- •Принцип Паули (1925)
- •Емкость n/уровней
- •Способы образования ковалентной связи.
- •Свойства связи.
- •Причины образования химической связи. Основы виды химической связи (ковалентная, ионная, металлическая)
- •Вопрос № 9. Ионная связь и металлическая связь. Ионная связь, ее свойства
- •Свойства связи.
- •Вопрос № 10. Метод валентных связей. Валентность по донорно-акцепторному и обменному механизму.
- •Способы образования ковалентной связи.
- •Донорно-акцепторная связь – разновидность ковалентной связи.
- •Вопрос № 11. Метод молекулярных орбиталей. Его сравнение с методом валентных связей.
- •14. Термодинамические функции:
- •16. Энтропия образования химических соединений.
- •17. Энергия Гиббса образования вещества.
- •18. Обратимые химические реакции. Химическое равновесие. Условия термодинамического равновесия.
- •19. Скорость химических реакций в гомогенных и гетерогенных процессах. Факторы, изменяющие скорость химических реакций.
- •21. Влияние температуры на скорость реакций.
- •Топливный элемент. Принцип работы кислородно-водородного топливного элемента.
- •Основные методы защиты от коррозии. Протекторы, ингибиторы коррозии.
- •Методы получения полимеров. Привести примеры реакций полимеризации и поликонденсации.
16. Энтропия образования химических соединений.
Энтропия (S) связана с числом W равновероятных микроскопических состояний, которыми можно реализовать данное макроскопическое состояние системы, уравнением: S=klgW, к- коэффициент пропорциональности.
Наименьшую энтропию имеют идеально правильно построенные кристаллы при абсолютном нуле. С повышением температуры энтропия возрастает, т.к. возрастает интенсивность движения частиц, растет число способов их расположения. Изменяется энтропия при протекании химических процессов. Увеличение числа газовых молекул приводит к возрастанию энтропии, уменьшение – ее понижению.
Подобно внутренней энергии и энтальпии, энтропия зависит только от состояния системы. Но, в отличие от этих двух функций, связь изменения энтропии с теплотой зависит от способа проведения процесса – от его скорости.
Если процесс проводится обратимо и при постоянной температуре, то изменение энтропии связано с поглощаемой теплотой уравнением:
S=Qобр/Т, Qобр- кол-во теплоты, поглощенной системой в изотермическом обратимом процессе; Т – абсолютная температура. С помощью этой формулы можно определить изменение энтропии при плавлении и кипении веществ. При поглощении некоторого кол-ва теплоты энтропия системы возрастает тем сильнее, чем ниже температура, при которой поглощается теплота. Энтропия имеет размерность энергии, деленной на температуру: выражают в Дж/К.
Энтропия и ее изменение при химических реакции
Многие процессы протекают без подвода энергии извне. Такие процессы называются самопроизвольными.
Например: переход теплоты от нагретого тела к менее нагретому, смешивание газов, образование ржавчины на металлах, реакция многих металлов с кислородом и др.
Как показывает опыт, одной из движущих
сил самопроизвольного течения реакции
является уменьшение энтальпии системы,
т.е. ее экзотермичность (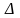 Н).
Однако известны эндотермические
самопроизвольно протекающие процессы,
у которых
Н
> 0. Например, растворение NH4N03
(ДН = 25,7 кДж/моль). происходит за счет
внутренних процессов в системе. При
растворении кристаллы соли распадаются
на ионы, которые в гидратирован-ном
состоянии совершают более хаотические
движения, чем в кристалле. Таким
образам система переходит от более
упорядоченного состояния к менее
упорядоченному. Отсюда следует, что
кроме уменьшения энтальпии системы
(энтальпийный фактор) имеется другая
движущая сила самопроизвольного процесса
- стремление к беспорядку.
Н).
Однако известны эндотермические
самопроизвольно протекающие процессы,
у которых
Н
> 0. Например, растворение NH4N03
(ДН = 25,7 кДж/моль). происходит за счет
внутренних процессов в системе. При
растворении кристаллы соли распадаются
на ионы, которые в гидратирован-ном
состоянии совершают более хаотические
движения, чем в кристалле. Таким
образам система переходит от более
упорядоченного состояния к менее
упорядоченному. Отсюда следует, что
кроме уменьшения энтальпии системы
(энтальпийный фактор) имеется другая
движущая сила самопроизвольного процесса
- стремление к беспорядку.
Мерой неупорядоченности состояния системы служит термодинамическая величина – энтропия (S0298 Дж/моль*К).
В отличие от других термодинамических величин можно определить не только изменение, но и абсолютное значение энтропии. Между энтропией (мерой беспорядка) и вероятностью состояния (W) существует связь, выраженная формулой Больцмана:
S=K*InW, где К=1,38*10-23 Дж/К(постоянная Больцмана)
Характеристика энтропии дается во втором и третьем началах термодинамики:
II начало термодинамики: в изолированной системе самопроизвольно могут протекать только такие процессы (и химические .реакции), при которых энтропия возрастает.
III начало термодинамики; при абсолютном нуле энтропия идеального кристалла равна нулю.
Энтропия растет с повышением температуры, поэтому количественно
энтропия выражается произведением абсолютной температуры на энтропию системы, Т.е. Т S Дж/моль 8 Дж/моль. Агрегатное состояние также влияет на величину энтропии: энтропия растет при переходе от твердого агрегатного состояния к жидкому и далее к газообразному. Изменение энтропии химической реакции рассчитывается по уравнению:.
Значения энтропии в стандартных условиях берутся в табл., при расчете следует учитывать стехиометрические коэффициенты перед веществами в реакции. После рассмотрения основных понятий об энтальпии и энтропии следует сделать вывод: в химических процессах одновременно действуют два фактора, приводящих к самопроизвольному протеканию химических реакций — энтальпийный (понижение энергии системы) и энтропийный (стремление к беспорядку). Суммарный эффект этих двух факторов в изобарноизотермических условиях (Р и Т - const) определяет направленность
химической реакции.
S0
х.р. =
 S0 прод. реакции.
-
S0 исход. веществ
S0 прод. реакции.
-
S0 исход. веществ
Величиной, указывающей на направление реакций, является энергияГиббса (G°298)
№16
