
- •Вопрос № 2
- •Вопрос № 3 Двойственная природа электрона. Корпускулярные и волновые свойства электрона. Уравнение де Бройля.
- •Вопрос № 4.
- •Вопрос № 5. Радиоактивный распад, его типы. Закон смещения. Радиоактивность. Виды радиоактивных лучей, их характеристика.
- •Принцип Паули (1925)
- •Емкость n/уровней
- •Способы образования ковалентной связи.
- •Свойства связи.
- •Причины образования химической связи. Основы виды химической связи (ковалентная, ионная, металлическая)
- •Вопрос № 9. Ионная связь и металлическая связь. Ионная связь, ее свойства
- •Свойства связи.
- •Вопрос № 10. Метод валентных связей. Валентность по донорно-акцепторному и обменному механизму.
- •Способы образования ковалентной связи.
- •Донорно-акцепторная связь – разновидность ковалентной связи.
- •Вопрос № 11. Метод молекулярных орбиталей. Его сравнение с методом валентных связей.
- •14. Термодинамические функции:
- •16. Энтропия образования химических соединений.
- •17. Энергия Гиббса образования вещества.
- •18. Обратимые химические реакции. Химическое равновесие. Условия термодинамического равновесия.
- •19. Скорость химических реакций в гомогенных и гетерогенных процессах. Факторы, изменяющие скорость химических реакций.
- •21. Влияние температуры на скорость реакций.
- •Топливный элемент. Принцип работы кислородно-водородного топливного элемента.
- •Основные методы защиты от коррозии. Протекторы, ингибиторы коррозии.
- •Методы получения полимеров. Привести примеры реакций полимеризации и поликонденсации.
21. Влияние температуры на скорость реакций.
Для того, чтобы произошла реакция, необходимо сначала разорвать или ослабить связи между атомами молекул исходных веществ. избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества называется энергией активации данной реакции. Энергия активации выражается в кДж/моль. Молекулы обладающие такой энергией называются активными.
Сростом температуры число активных молекул возрастает. Скорость химической реакции возрастает с повышением температуры. Возрастание скорости реакции с ростом температуры принято характеризовать температурным коэффициентом скорости реакции – числом, показывающим во сколько раз возрастает скорость данной реакции при повышении температуры на 10 градусов. При обычных температурах значение коэффициента для большинства реакций лежит в пределах от 2 до 4.
Влияние изменения температур!
Равновесие подавляющего большинства химических реакций сдвигается при изменении температуры. Фактором, который определяет направление смещения равновесия, является при этом знак теплового эффекта реакции:
при повышении температуры равновесие смещается в направлении эндотермической, а при понижении - в направлении экзотермической реакции.
Знак теплового эффекта реакции определяется по значению энтальпии реакции.
№ 22 Катализ и катализаторы. Механизмы гомогенного и гетерогенного катализа. Примеры этих типов катализа. Основные области применения катализаторов.
Вещества, не расходующиеся в результате протекания реакции, но влияющие на ее скорость, называются катализаторами. Явление изменения скорости реакции под действием таких веществ называется катализом. Реакции, протекающие под действием катализаторов, называются каталитическими.
В большинстве случаев действие катализатора объясняется тем, что он снижает энергию активации реакции. В присутствии катализатора реакция проходит через другие промежуточные стадии, чем без него, причем эти стадии энергетически более доступны. Иначе говоря, в присутствии катализатора возникают другие активированные комплексы, причем для их образования требуется меньше энергии, чем для образования активированных комплексов, возникающих без катализатора. Таким образом, энергия активации реакции понижается; некоторые молекулы, энергия которых была недостаточна для активных столкновений, теперь оказываются активными.
Для ряда реакций промежуточные соединения изучены; как правило, они представляют собою весьма активные нестойкие продукты.
В химической промышленности катализаторы применяются весьма широко. Под влиянием катализаторов реакции могут ускоряться в миллионы раз и более. В некоторых случаях под действием катализаторов могут возбуждаться такие реакции, которые без них в данных условиях практически не протекают.
Различают гомогенный и гетерогенный катализ.
В случае гомогенного катализа катализатор и реагирующие вещества образуют одну фазу (газ или раствор). В случае гетерогенного катализа катализатор находится в системе в виде самостоятельной фазы.
Примером гомогенного катализа может
служить каталитическое разложение
пероксида водорода в водном растворе
на воду и кислород. Ионы
 катализирующие разложение пероксида
водорода, образуют с ним промежуточные
соединения, которые далее распадаются
с выделением кислорода.
катализирующие разложение пероксида
водорода, образуют с ним промежуточные
соединения, которые далее распадаются
с выделением кислорода.
Широкое применение в химической промышленности находит гетерогенный катализ. При гетерогенном катализе реакция протекает на поверхности катализатора. Отсюда следует, что активность катализатора зависит от величины и свойств его поверхности. Для того чтобы иметь большую («развитую») поверхность, катализатор должен обладать пористой структурой или находиться в сильно раздробленном (высокодисперсном) состоянии. При практическом применении катализатор обычно наносят а носитель, имеющий пористую структуру (пемза, асбест и др.).
Как и в случае гомогенного катализа, при гетерогенном катализе реакция протекает через активные промежуточные соединения. Но здесь эти соединения представляют собой поверхностные соединения катализатора с реагирующими веществами. Проходя через ряд стадий, в которых участвуют эти промежуточные соединения, реакция заканчивается образованием конечных продуктов, а катализатор в результате не расходуется.
В качестве примеров гетерогенно-каталитических реакций моно указать окисление диоксида серы в триоксид при контактном методе производства серной кислоты, синтез аммиака, окисление аммиака при производстве азотной кислоты.
Очень большую роль играет катализ в биологических системах. Большинство химических реакций, протекающих в пищеварительной системе, в крови и в клетках животных и человека, являются каталитическими реакциями. Катализаторы, называемые в этом случае ферментами, представляют собой простые или сложные белки. Так, слюна содержит фермент птиалин, который катализирует превращение крахмала в сахар. Фермент, имеющийся в желудке, - пепсин – катализирует расщепление белков.
№ 23 Зонная теория кристаллов. Полупроводники. Типы проводимости. Диэлектрики. Металлы с точки зрения зонной теории кристаллов.
Зонная теория кристаллов. Эта теория объясняет электропроводимость на основе квантовой теории строения кристаллических тел. Химическую связь в металле описывают с помощью метода молекулярных орбиталей.
В процессе образования кристалла, согласно ММО, при сближении 2-х АО образуются 2 МО с более высоким и с более низким уровнем энергии. Если сближается большое число АО, то образуется много МО. Если в кристалле число АО = 10 23 , то МО образуют энергетическую зону. При этом соседняя МО имеет очень малую разницу в энергии. Электроны находясь на МО могут легко переходить с одной МО на другую (освещение, нагревание, облучение, электрическая энергия). Соседняя МО находится на очень малом расстоянии и образуют почти сплошную энергетическую зону.
1 кристалл Na разность энергии 2-х соседних орбиталей равна
Е=10 -28
Если ширина зоны 1 эВ, то при наличии в ней 10-23 уровней энергетический зазор между соседними уровнями. При наложении разности потенциалов электроны будут свободно перемещаться.
Зонная структура металлов
Совокупность уровней занятых валентными электронами, называется валентной зоной. Уровни незаполненные называются зонами проводимости.
11Na 1S2 2S2 2P6 3S1 (валентная зона) 3P0 3D0
В металле валентная зона перекрывается с зоной проводимости, поэтому при наложении разности потенциалов электроны с валентной зоны легко переходят в зону проводимости и обуславливают электропроводимость
Зонная структура диэлектрика
В отличии от металла неметаллы не обладают электропроводимостью. Они представляют диэлектрики и изоляторы. В кристаллах неметаллов валентная зона отделена от зоны проводимости некоторым энергетическим барьером Е, поэтому энергия электрического поля оказывается недостаточной для перехода с валентной зоны в зону проводимости
Е > эВ
Е = 5.1 эВ (алмаз) Е = 5.2 эВ (кварц)
Зонная структура полупроводника
При сообщении полупроводнику определенного количества энергии (освещение, тепло, облучение, электрическая энергия) электроны с валентной зоны переходят в зону проводимости и участвую в переносе тока - собственные полупроводники
Ge Е = 0.66 эВ
Zn Е = 3.77 эВ
Cd Е = 2.42 эВ
Полупроводники и диэлектрики отличаются от проводников тем, что валентная зона заполняется почти полностью, а зона проводимости отделена энергетическим барьером. Особенность собственных полупроводников, что при переходе части электрона в зону проводимости, в валентной зоне появляется эквивалентное количество ионов или дырок, которые также участвуют в переносе тока. Проводимость полупроводников осуществляется как в зонной проводимости (N), так и дырками в валентной зоне (Р). Электроны движутся в зоне проводимости так, как это происходит в металле, а дырки движутся наоборот (от + к -). Таким образом собственные полупроводники имеют электронно-дырочную проводимость.
Наряду с собственными полупроводниками имеют большое значение полупроводники приместного типа. Полупроводники такого типа основное количество переносчиков тока (т.е. электронов и дырок) поставляют приместные добавки. Энергетические уровни этих добавок располагаются между валентной зоной и зоной проводимости. В приместных полупроводниках путем соответствующего подбора добавок можно искусственно создать электронно-дырочную проводимость(N). В зависимости от типа добавки их разделяют на электронно-донорную и электронно-акцепторные. Полупроводники с донорной примесью обладают N проводимостью , т.к. примеси дают электроны в зону проводимости. При кристаллизации Ge – атомы примесей отдают 4 электрона с наружного уровня используют на связи кристаллической решетки, 5-ый электрон примесь отдает проводимости и за счет этого получает проводимость. Акцепторная примесь сообщает полупроводнику Р- проводимость или дырочную.
Например: к Ge добавляют элементы 3 группы
32 Ge…4S2 4P2
13Al…3S2 3P1, добавка введенная в полупроводник кристаллической решетки Ge захватывая недостающий электрон у соседнего атома Ge, а на этом месте у Ge остается дырка.
Донорными являются примеси атомы в которых сообщают полупроводнику N – проводимость, т.к. их атомы имеют больше валентных электронов, чем собственная полупроводимость.
Акцепторные примеси – это примеси сообщающие Р – проводимость и имеющие валентных электрон меньше чем атомы полупроводников.
Если на 100 млн. атомов Ge ввести 1 атом As – мышьяка, то полупроводник будет иметь N – проводимость.
Если на 100 млн. атомов Ge ввести 1 атом В – бора, то полупроводник будет иметь Р – проводимость.
№ 23
№ 24 Общие свойства растворов. Состав растворов, способы его выражения (массовая доля, молярная концентрация компонента, молярная концентрация эквивалента, моляльность).
Раствором называется твердая или жидкая гомогенная система, состоящая из двух или более компонентов (составных частей), относительные количества которых могут изменяться в широких пределах.
Всякий раствор состоит из растворенных веществ и растворителя, т.е. среды, в которой эти вещества равномерно распределены в виде молекул или ионов. Обычно растворителем считают тот компонент, который в чистом виде существует в таком же агрегатном состоянии, что и полученный раствор. Если же оба компонента до растворения находились в одинаковом агрегатном состоянии (например, спирт и вода), то растворителем считается компонент, находящийся в большем количестве.
Раствор, находящийся в равновесии с растворяющимся веществом, называется насыщенным раствором.
Способы выражения состава растворов.
Насыщенные растворы применяют сравнительно редко. В большинстве случаев пользуются ненасыщенными растворами, содержащими меньше растворенного вещества, чем его содержит при данной температуре насыщенный раствор. При этом растворы с низким содержанием растворенного вещества называются разбавленными, с высоким – концентрированными.
Состав раствора (и, в частности, содержание в нем растворенного вещества) может выражаться разными способами – как с помощью безразмерных единиц (долей или процентов), так и через размерные величины – концентрации. В химической практике наиболее употребительны следующие величины, выражающие содержание растворенного вещества в растворе:
Массовая доля – отношение (обычно - процентное) массы растворенного вещества к массе раствора. Например, 15% (масс.) водный раствор хлорида натрия – это такой раствор, в 100 единицах массы которого содержится 15 единиц массы NaCl b 85 единиц массы воды.
Мольная доля – отношение количества растворенного вещества (или растворителя) к сумме количеств всех веществ, составляющих растворов. В случае раствора одного вещества в другом мольная доля растворенного вещества (N2) равна
N2 = n2/(n1+n2)
А мольная доля растворителя (N1)
N1 = n1/(n1+n2)
Где n1 и n2 – соответственно количества вещества растворителя и растворенного вещества.
Молярная концентрация, или молярность – отношение количества растворенного вещества к объему раствора. Обычно молярность обозначается См или (после численного значения молярности) М. так, 2М H2SO4 означает раствор, в каждом литре которого содержится 2 моля серной кислоты, т.е. См = 2 моль\л.
Моляльная концентрация, моляльность – отношение количества растворенного вещества к массе растворителя. Обычно моляльность обозначается буквой m. Так, для раствора серной кислоты запись m = 2 моль\кг (Н2О) означает, что в этом растворе на каждый килограмм растворителя (воды) приходится 2 моля H2SO4. моляльность раствора в отличие от его молярности не изменяется при изменении температуры.
Эквивалентная, или нормальная концентрация – отношение числа эквивалентов растворенного вещества к объему раствора. Концентрация, выраженная этим способом, обозначается Сн или (после численного значения нормальности) буквой н. так, 2 н. H2SO4 означает раствор, в каждом литре которого содержится 2 эквивалента серной кислоты, т.е. Сн (1\2 H2SO4) = 2 моль\л.
Пользуясь растворами, концентрация которых выражена нормальностью, легко заранее рассчитать, в каких объемных отношениях они должны быть смешаны., чтобы Растворенные вещества прореагировали без остатка. Пусть V1 л раствора вещества 1 с нормальностью N1 реагирует с V2 л раствора вещества 2 с нормальностью N2. это означает, что в реакцию вступило N1V1 эквивалентов вещества 1 и N2V2 эквивалентов вещества 2. но вещества реагируют в эквивалентных количествах, следовательно
N1V1= N2V2
Или
V1: V2 = N2: N1
Таким образом, объемы растворов реагирующих веществ обратно пропорциональны их нормальностям.
№ 24
№ 25. Сильные и слабые электролиты. Теория электролитической диссоциации. Закон Оствальда. Ионообменные реакции в растворах электролитов.
Сильные электролиты в водных растворах диссоциированы практически нацело. Понятие степени диссоциации к ним по существу неприменимо, а отклонение изотонического коэффициента i от целочисленных значений объясняется другими причинами. Слабые электролиты в водных растворах диссоциируют только частично, и в растворе устанавливается динамическое равновесие между недиссоциированными молекулами и ионами.
К сильным электролитам принадлежат почти все соли; из важнейших кислот и оснований к ним относятся HNO3, H2SO4, HClO4, HCl, HBr, HI, KOH, NaOH, Ba(OH)2, Ca(OH)2.
К слабым электролитам относится большинство органических кислот, а из важнейших неорганических соединений к ним принадлежат H2CO3, H2S, HCN, H2SiO3, NH4OH.
Теория электролитической диссоциации
Согласно этой теории, при растворении в воде электролиты распадаются (диссоциируют) на положительно и отрицательно заряженные ионы. Положительно заряженные ионы называются катионами; к ним относятся, например, ионы водорода и металлов. Отрицательно заряженные ионы называются анионами; к ним принадлежат ионы кислотных остатков и гидроксид-ионы. Как и молекулы растворителя, ионы в растворе находятся в состоянии неупорядоченного теплового движения.
Процесс электролитической диссоциации изображают, пользуясь химическими уравнениями. Например, диссоциация HCl выразится уравнением:
HCl = Н+ + Cl-
Если обозначить концентрацию электролита, распадающегося на два иона, через С, а степень его диссоциации в данном растворе через , то концентрация каждого из ионов будет С, а концентрация недиссоциированных молекул С(1 - ). Тогда уравнение константы диссоциации принимает вид:
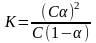 Или
Или
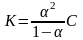
Это уравнение выражает закон разбавления Оствальда. Оно дает возможность вычислять степень диссоциации при различных концентрациях электролита, если известна его константа диссоциации. Пользуясь этим уравнением, можно также вычислить константу диссоциации электролита, зная его степень диссоциации при той или иной концентрации.
Для растворов, в которых диссоциация электролита очень мала, уравнение закона Оствальда упрощается. Поскольку в таких случаях << 1, то величиной в знаменателе правой части уравнения можно пренебречь. При это уравнение принимает вид:
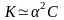 или
или 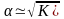
Это уравнение наглядно показывает связь, существующую между концентрацией слабого электролита и степенью его диссоциации: степень диссоциации возрастает при разбавлении раствора.
Как всякое химическое равновесие, равновесие в растворе слабого электролита является динамическим, т.е. при его установлении протекают с равными скоростями два процесса: процесс диссоциации и обратный ему процесс образования молекул из ионов. При этом разбавлении раствора не препятствует первому из этих процессов – диссоциации. Однако процесс образования молекул из ионов в результате разбавления затрудняется: для образования молекулы должно произойти столкновение ионов, вероятность которого с разбавлением уменьшается.
В зависимости от структуры растворяющегося вещества в безводном состоянии его диссоциация протекает по-разному. Наиболее типичны при этом два случая. Один из них – это диссоциация растворяющихся солей, т.е. кристаллов с ионной структурой, второй – диссоциация при растворении кислот, т.е. веществ, состоящих из полярных молекул.
Когда кристалл соли, например, хлорид калия, попадает в воду, то расположенные на его поверхности ионы притягивают к себе полярные молекулы воды (ион-дипольное взаимодействие). К ионам калия молекулы воды притягиваются своими отрицательными полюсами, а к хлорид – ионам – положительными.
Иначе протекает диссоциация полярных молекул. Молекулы воды, притянувшиеся к концам полярной молекулы (диполь-дипольное взаимодействие), вызывают расхождение ее полюсов – поляризуют молекулу. Такая поляризация в сочетании с колебательным тепловым движением атомов в рассматриваемой молекуле, а также с непрерывным тепловым движением окружающих ее молекул воды приводит в конечном счете к распаду полярной молекулы на ионы.
№ 25.
№ 26 Жесткость воды. Соли жесткости.
Природная вода, содержащая в растворе большое количество солей кальция или магния, называется жесткой водой в противоположность мягкой воде, содержащей мало солей кальция или магния или совсем не содержащей их.
Суммарное содержание этих солей в воде называется ее общей жесткостью. Она подразделяется на карбонатную и некарбонатную жесткость. Первая из них обусловлена присутствием гидрокарбонатов кальция и магния, вторая – присутствием солей сильных кислот – сульфатов или хлоридов кальция или магния. При длительном кипячении воды, обладающей карбонатной жесткостью, в ней появляется осадок, состоящий главным образом из СаСО3, и одновременно выделяется СО2. Оба эти вещества появляются вследствие разложения гидрокарбоната кальция:
Са(НСО3)2 = СаСО3 + СО2 + Н2О
Поэтому карбонатную жесткость называют временной жесткостью. Количественно временную жесткость характеризуют содержанием гидрокарбонатов, удаляющихся из воды при ее кипячении в течение часа. Жесткость, остающаяся после такого кипячения, называется постоянной жесткостью.
Присутствие в воде значительного количества солей кальция или магния делает воду непригодной для многих технических целей. Так, при продолжительном питании паровых котлов жесткой водой их стенки постепенно покрываются плотной коркой накипи. Такая корка уже при толщине 1 мм сильно понижает передачу теплоты стенками котла и, следовательно, ведет к увеличению расхода топлива. Кроме того, она может служить причиной образования вздутий и трещин как в кипятильных трубах, так и на стенках самого котла.
Жесткая вода не дает пены с мылом, так как содержащиеся в мыле растворимые натриевые соли жирных кислот – пальмитиновой и стеариновой – переходят в нерастворимые кальциевые соли тех же кислот:
2C17H35COONa + CaSO4 = (C17H35COO)2Ca + Na2SO4
Для водоумягчения применяют методы осаждения и ионного обмена. Путем осаждения катионы Ca2+ и Mg2+ переводят в малорастворимые соединения, выпадающие в осадок. Это достигается либо кипячением воды, либо химическим путем – введением в воду соответствующих реагентов. При кипячении гидрокарбонаты кальция им Агния превращаются в СаСО3 и Mg(ОН)2
Са(НСО3)2 = СаСО3 + СО2 + Н2О
Mg(НСО3)2 = Mg(ОН)2 + 2СО2
В результате чего устраняется только карбонатная жесткость.
Для устранения жесткости методом ионного обмена или катионирования воду пропускают через слой катионита. При этом катионы Ca2+ и Mg2+, находящиеся в воде, обмениваются на катионы и анионы. В таких случаях воду пропускают последовательно через катионит, содержащий в обменной форме водородные ионы (Н - катионит), и анионит, содержащий гидроксид – ионы (ОН - анионит). В итоге вода освобождается как от катионов, так и от анионов солей. Такая обработка воды называется ее обессоливанием.
Когда процесс ионного обмена доходит до равновесия, ионит перестает работать – утрачивает способность умягчать воду. Однако любой ионит легко подвергается регенерации. Для этого через катионит пропускают концентрированный раствор NaCl(Na2SO4) или HCl(H2SO4). При этом ионы Ca2+ и Mg2+ выходят в раствор, а катионит вновь насыщается ионами Na+ или Н+. для регенерации анионита его обрабатывают раствором щелочи или соды (последний, вследствие гидролиза карбонатного иона, также имеет щелочную реакцию). В результате поглощенные анионы вытесняются в раствор, а анионит вновь насыщается ионами ОН-
№ 27 Окислительно-восстановительные процессы: степень окисления, окислитель, восстановитель. Типы ОВР. Направление ОВР. Роль окислительно-восстановительных процессов.
Реакции, в результате которых изменяются степени окисленности элементов, называются окислительно-восстановительными.
Степень окисления – это условный заряд атома в соединении, вычисленный из предположения, что молекула состоит из ионов. Для нахождения неизвестной степени окисления атома используют следующие правила:
водород во всех своих соединениях, кроме гидридов щелочных и щелочно-земельных металлов, имеет степень окисления +1. в гидридах щелочных и щелочноземельных металлов степень окисления водорода равна -1.
кислород почти всегда имеет степень окисления -2. исключение составляют пероксиды и фторид кислорода (
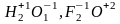 ).
).фтор во всех соединениях имеет степень окисления -1
степень окисления катионов металлов 1-3 групп периодической системы равны номеру группы, за исключением золота, меди, серебра.
высшая положительная степень окисления атомов 4-7 группы равна номеру группы, но есть и более низкие положительные степени окисления, которые вычисляются из соединений этого элемента. Например, в оксидах азота N2О5, NО2, NО, N2О степень окисления азота равна +5, +4, +2, +1 соответственно.
атомы в молекулах простых веществ имеют степень окисления, равную нулю.
алгебраическая сумма степени окисления атомов, образующих молекулы, равна нулю.
исходя из вышеуказанного можно найти степень окисления атома, входящего в состав молекулы. Например: найти степень окисления серы в молекуле H2SO4. у водорода и кислорода степени окисления равны соответственно +1, -2. отсюда
2+х-8=0 (х – степень окисления серы). Х = 8-2 = 6. степень окисления серы равна +6.
Число электронов, смещенных от одного атома данного элемента (при положительной окисленности) или к одному атому данного элемента (при отрицательной окисленности), называется степенью окисления элемента.
Отдача электронов, сопровождающаяся повышением степени окисленности элемента, - называется окислением.
Присоединение электронов, сопровождающееся понижением степени окисленности элемента, называется восстановлением.
Вещество, в состав которого входит окисляющийся элемент, называется восстановителем, а вещество, содержащее восстанавливающийся элемент, окислителем.
Общее число электронов в системе при химических реакциях не изменяется: число электронов, отдаваемых молекулами (атомами, ионами) восстановителя, равно числу электронов, присоединяемых молекулами (атомами, ионами) окислителя.
Вес химические реакции можно разбить на две группы. В реакциях первой группы окисленность всех элементов, входящих в состав реагирующих веществ, остается неизменной, а в реакциях второй группы окисленность одного или нескольких элементов изменяется.
Окислительно-восстановительные реакции имеют очень большое значение в биологических системах. Фотосинтез, дыхание, пищеварение – все это цепи окислительно-восстановительных реакций. В технике значение окислительно-восстановительных реакций также очень велико. Так, вся металлургическая промышленность основана на окислительно-восстановительных процессах, в ходе которых металлы выделяются из природных соединений.
№ 29 Металлы: методы получения, очистка, физические и химические свойства. Как реагируют металлы с кислотами и щелочами.
Пирометаллургия основана на восстановлении металлов из безводных соединений при высоких температурах. В качестве восстановителей используют С (кокс), СО, Н2, металлы – Al (алюминотермия), Mg (магнийтермия):
А) восстановление из оксидов металлов
Cu2O + C 2Cu + CO
Б) восстановление из сульфидов
2ZnS + 3О2 2ZnO + 2SО2 (обжиг)
ZnO + C Zn + CO
В) восстановление металлами (металлотермия)
Fe2O3 + 2 Al Al2O + 2Fe + Q
Гидрометаллургия. Металлы извлекают из руд с помощью водных растворов различных реагентов (кислот, щелочей или солей). Затем происходит восстановление металла из раствора его соли путем электролиза. Так, если в руде есть оксид меди двухвалентной, то после обработки руды серной кислотой получают сульфат меди:
CuO + H2SO4 CuSO4 + H2O
Затем раствор сульфата меди подвергают электролизу и получают медь.
Электрометаллургия. Восстановление металла происходит при электролизе на катоде. Электролизом водных растворов могут быть получены лишь сравнительно малоактивные металлы. Активные же металлы, такие как щелочные, щелочноземельные, алюминий, получают исключительно электролизом расплавов их солей по схеме:
КАТОД Na+Cl- АНОД
расплав
Na+ + e Na0 2Cl- - 2e Cl20
2Na+ + 2Cl- 2Na0 + Cl20
Обычно руды представляют собой совокупность минералов. Минералы, содержащие извлекаемый металл, называются рудными минералами, все остальные – пустой породой. Чтобы облегчить выплавку металла, к руде примешивают специальные вещества – флюсы. Флюсы образуют с веществами пустой породы легкоплавкие соединения – шлаки, которые обычно собираются на поверхности расплавленного металла и удаляются.
Физические свойства
Плотность металлов выражается массой единицы объема и колеблется в очень широких пределах: от 0,53 у лития до 22,6 г\см3 у осмия. По назначению плотности все металлы в технике делят на легкие, у которых плотность меньше 5 см3, и тяжелые – плотность и них больше 5 г\см3.
Способность металлов к пластической деформации обусловлена особенностью их кристаллической структуры, связанной с наличием свободно перемещающихся электронов между узлами решетки.
Твердость – это сопротивление проникновению в металл другого твердого тела.
Непрозрачность металлов также обусловлена присутствием в кристаллической решетке свободных электронов.
Металлический блеск объясняется тем, что металлы отражают большую долю падающего на них света.
Характерным химическим свойством металлов является их восстановительная способность, которая проявляется при взаимодействии металлов с кислородом, водой, кислотами, щелочами и различными другими соединениями, обладающими окислительными свойствами.
Реакции, в результате которых изменяются степени окисленности элементов, называются окислительно-восстановительными.
Степень окисления – это условный заряд атома в соединении, вычисленный из предположения, что молекула состоит из ионов. Для нахождения неизвестной степени окисления атома используют следующие правила:
Для нахождения неизвестной степени окисления атома используют следующие правила:
водород во всех своих соединениях, кроме гидридов щелочных и щелочно-земельных металлов, имеет степень окисления +1. в гидридах щелочных и щелочноземельных металлов степень окисления водорода равна -1.
кислород почти всегда имеет степень окисления -2. исключение составляют пероксиды и фторид кислорода ( ).
фтор во всех соединениях имеет степень окисления -1
степень окисления катионов металлов 1-3 групп периодической системы равны номеру группы, за исключением золота, меди, серебра.
высшая положительная степень окисления атомов 4-7 группы равна номеру группы, но есть и более низкие положительные степени окисления, которые вычисляются из соединений этого элемента. Например, в оксидах азота N2О5, NО2, NО, N2О степень окисления азота равна +5, +4, +2, +1 соответственно.
атомы в молекулах простых веществ имеют степень окисления, равную нулю.
алгебраическая сумма степени окисления атомов, образующих молекулы, равна нулю.
исходя из вышеуказанного можно найти степень окисления атома, входящего в состав молекулы. Например: найти степень окисления серы в молекуле H2SO4. у водорода и кислорода степени окисления равны соответственно +1, -2. отсюда
2+х-8=0 (х – степень окисления серы). Х = 8-2 = 6. степень окисления серы равна +6.
При взаимодействии металла с кислотой образуется соль с выделением кислорода.
Щелочи действуют только на металлы, образующие амфотерные оксиды и гидроксиды. При этом выделяется водород и образуется соль очень слабой кислоты данного металла. Следует отметить, что образование водорода является результатом взаимодействия атомов метала с ионами водорода воды, а не водорода, входящего в состав щелочи.
№ 29
№30 Двойной электрический слой. Электрохимическая система. Проводник 1 и 2 рода. Стандартный водородный электрод. Водородная шкала электродных потенциалов. Уравнение Нернста. Электродные потенциалы и ЭДС.
Максимальное значение напряжения гальванического элемента, соответствующее обратимому протеканию реакции, называется электродвижущей силой (э.д.с.) данного элемента.
Электродные потенциалы – разность двух величин полуреакций
Е =

Уравнение Нернста – из него установлено, что величины электродных потенциалов зависят от:
природы веществ – участников электродного процесса,
соотношения между концентрациями веществ
температура системы.
Все эти зависимости выражены в уравнении:
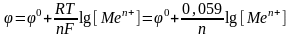
Где
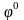 - стандартный электродный потенциал;
- стандартный электродный потенциал;
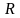 - газовая постоянная; Т – абсолютная
температура (298 К);
- газовая постоянная; Т – абсолютная
температура (298 К);
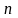 - число электронов;.
- число электронов;.
Стандартный электродный потенциал – это потенциал данного электродного процесса при концентрациях все участвующих в нем веществ, равных единице.
Водородная шкала – в ее основе лежит электродный процесс:
2Н+ + 2е = Н2
Водородный электрод. Представляет собой платиновую пластинку, электролитически покрытую губчатой платиной и погруженную в раствор кислоты, через которую пропускается водород. Водород хорошо растворяется в платине; при этом молекулы водорода частично распадаются на атомы. На поверхности соприкосновения платины с раствором кислоты может протекать окисление атомов или восстановление ионов водорода. Платина при этом практически не принимает участия в электродных реакциях и играет как бы роль губки, пропитанной атомарным водородом.
Потенциал водородного электрода воспроизводится с очень высокой точностью. Поэтому водородный электрод и принят в качестве эталона при создании шкалы электродных потенциалов.
Двойной электрический слой – тонкий поверхностный слой из пространственно разделенных электрических зарядов противоположного знака. В дисперсных системах двойной электрический слой образуют ионы и дипольные молекулы.
Проводник 1 рода — имеющий электронную проводимость. Проводник 2 рода — имеющий ионную проводимость (раствор). Электрод — проводник 1 рода, находящийся в контакте с ионным проводником. Электрод 1 рода — металл/неметалл, погружённый в раствор, содержащий ионы данного металла/неметалла. Электрод 2 рода — металл, покрытый слоем трудно растворимой соли и погружённый в электролит, содержащий ионы этой соли.
Основные элементы электрохимической системы: электроды (металлы, полупроводники), электролиты с ионной проводимостью (раствор, расплав, твёрдое вещество), граница раздела фаз (электролит | электрод). Электрод — проводник 1 рода, находящийся в контакте с ионным проводником. Электрод 1 рода — металл/неметалл, погружённый в раствор, содержащий ионы данного еталла/неметалла. Электрод 2 рода — металл, покрытый слоем труднорастворимой соли и погружённый в электролит, содержащий ионы этой соли. Электролиты - вещества распадающиеся в растворах или расплавах на ионы. Электролитами являются соли, кислоты и основания.
№30
№31 Электролиз, последовательность электронных процессов. Электролиз растворов хлорида натрия, гидроксида натрия. Применение электролиза. Гальванопокрытия.
Электролизом называется совокупность процессов, происходящих при прохождении постоянного электрического тока через электрохимическую систему, состоящую из двух электродов и расплава или раствора электролита.
Последовательность электродных процессов на катоде происходит в порядке от больших потенциалов к меньшим. При этом возможны три случая:
катионы металлов, имеющих малую величину стандартного потенциала (от Li до Al включительно), не восстанавливаются на катоде, а вместо них восстанавливаются молекулы воды: 2Н2О + 2е Н2 + 2ОН-
Катионы металлов, имеющих стандартный потенциал меньший, чем у водорода, но больший, чем у алюминия (от Mn2+ до Н+) при электролизе на катоде восстанавливаются одновременно с молекулами воды
катионы металлов, имеющих стандартный потенциал больший, чем у водорода (от Cu2+ до Au+), при электролизе практически полностью восстанавливаются на катоде.
Процессы, происходящие у анода, завися как от вещества, из которого сделан анод, так и от электролита.
Электролиз раствора Na Cl
Na+, Н+ Катод 2Н2О + 2е Н2 + 2ОН- 2 (NaОН)
Cl- , ОН- Анод 2Cl- - 2е Cl2 1
2Н2О + 2Cl- Н2 + 2ОН- + Cl2
Натрий имеет очень малую величину электродного потенциала. У катода будет происходить восстановление водорода и накопление ионов ОН-. У анода происходит окисление Cl- до свободного состояния.
Применение электролиза
Важнейшее применение электролиз находит в металлургии, химической промышленности и в гальванотехнике. В химической промышленности методом электролиза получают хлор, фтор, едкий натр, перекись водорода; синтезируют органические соединения.
В металлургии электролизом расплавленных соединений и водных растворов получают металлы (Cd, Bi, Sn, Pb, Ni, Al, Zn, K, Na, Mg), а также производят электролитическое рафинирование – очистку металлов от вредных примесей и извлечение ценных компонентов. Электролитическому рафинированию подвергаются медь, никель, свинец, олово, серебро, золото.
Гальванопокрытия.
Гальваностегия – нанесение путем электролиза на поверхность металлических изделий слоев других металлов для предохранения изделий от коррозии, для придания их поверхности твердости, а также в декоративных целях (хромирование, никелирование, цинкование, кадмирование, меднение).
Гальванопластика – процессы получения точны металлических покрытий с рельефных предметов электроосаждением металла (матрицы для прессования, печатные радиотехнические схемы, типографские клише).
Законы Фарадея
1 Закон. Масса вещества, образовавшегося или растворившегося при электролизе, пропорциональна количеству электричества, прошедшего через электролит, и не зависит от других факторов
m = kQ
где k – электрохимический эквивалент, k = mэ/F.
2 Закон. Равные количества электричества выделяют при электролизе на электродах эквивалентные массы различных веществ. Для выделения на электроде одного эквивалента вещества необходимо затратить 96487 кулонов (это число называют числом Фарадея).

где mэ – масса
эквивалента, I – сила
тока, А;
 - продолжительность электролиза, с; m
– масса вещества, г.
- продолжительность электролиза, с; m
– масса вещества, г.
Одним из показателей эффективности использования электроэнергии в процессах электролиза является выход по току, равный отношению теоретически необходимого количества электричества (по закону Фарадея) к практически затраченному при получении продукта, которое соответствует отношению массы mi полученного вещества к теоретически возможному, m, т.е.
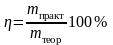
№31
Вопрос №33
Гальванический элемент. Принцип его работы. ЭДС гальванического элемента. Характеристики наиболее распространенных гальванических элементов.
В гальванич. эл-те хим. энергия преобразуется в химическую за счет электронных, т.е. окислительно-восстановительных, реакций. В гальванических элементах реакции получения электрического тока проводятся таким образом, чтобы процесс окисления и процесс восстановления протекали раздельно (на разных электродах). Это и приводит к тому, что на электродах гальванического элемента поддерживается разность потенциалов, определяющая собой электродвижущую силу (ЭДС) элемента.
ЭДС (Е°) электродвижущая сила гальванического элемента, в котором электрод с заданной полуреакцией
Ох+ne→R
(Ох – окислитель, R – восстановитель) соединен со стандартным водородным электродом. Величина Е° количественно характеризует силу окислителя и восстановителя. Чем больше
Е°, тем сильнее Ох как окислитель, и тем
слабее R как восстановитель.
Для получения реакции
 стандартный потенциал равен 0 В.
стандартный потенциал равен 0 В.
Медно-цинковый гальванич. эл-т.
Состоит из 1.внешней цепи элемента, проводник первого рода (электронный). В качестве такого обычно служит медная проволока. 2. проводника второго рода (ионный)., может служить узкая стеклянная трубочка, соединяющая левый и правый сосуды.
Трубочка обычно заполняется студенистым
вещ-вом, приготовленном на каком-нибудь
электролите (YKCl, NaCl
и т.д.) проводник второго рода препятствует
смешиванию растворов, находящихся в
обоих полуэлиментах, но проницаем для
ионов. В системе (атом Zn
–ион Сu) более электрофильным
оказывается катион меди. Он и оттягивает
на себя валентные электроны от атома
цинка. В результате этого цинк окисляется,
а катионы меди восстанавливаются до
металлического состояния. В левом
полуэл-те масса металлического электрода
понижается, а концентрация катионов
Zn повышается. В правом полуэл-те катионы
меди за счет электронов цинка
восстанавливаются до металлического
состояния. Масса медного электрода
возрастает, а концентрация ионов Cu
понижается.
повышается. В правом полуэл-те катионы
меди за счет электронов цинка
восстанавливаются до металлического
состояния. Масса медного электрода
возрастает, а концентрация ионов Cu
понижается.
При работе гальванич. эл-та от его минуса электроны по внешней цепи текут к положительному полюсу, а по внутренней цепи катионы цинка постепенно переходят в правый полуэлемент
Рассмотренную электрохимич. сист назыв. химич цепью и её записывают в след. виде:

наклонные линии символизируют собой границу между металлическим электродом и прилегающим к нему р-ом электролита в каждом данном полуэл-те, а // разделяет гальванический эл-т на полуэл-ты (граница между раст-ми).
Вопрос № 34
Аккумуляторы. Устройства, процессы, протекающие при зарядке и разрядке аккумулятора. Технические характеристики свинцовых и щелочных аккумуляторов. Приготовление аккумуляторной кислоты.
Аккумуляторы.
Химич. источники тока многократного использования назыв. аккумуляторы. Они способны превращ накопленную химическую энергию в электрическую при работе (разрядке), а электрическую в химическую при зарядке. При зарядке аккумулятор работает как электролизер, а при разрядке как гальванический элемент.
Аккумуляторы различают по:
электролитам
кислотные
щелочные
по электродам
в кислотах свинцовые электроды
в щелочных Fe-Ni, Cd-Ni, Ag-Zn
Электродом является серная кислота с ρ=1,27 г/см^3
В незаряженном аккумуляторе имеется
оксид свинца PbO+ при добавлении электролита проходит
реакция PbO+
при добавлении электролита проходит
реакция PbO+
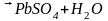
Чтобы зарядить аккумулятор к одной из свинцовых пластинок присоедин. к "-" , а к другому «+».
Свинцовый (кислотный) аккумулятор.
Аккумулятор состоит из свинцовых пластин в виде решеток или рам с ребристой поверхностью. Отверстия в пластинках заполнены пастой из окиси свинца PbO и воды. Подготовленные т.о. электроды опускаются в 25-30% р-р (электролит). При этом в результате взаимодействия оксида свинца с серной кислотой на поверхности пластины образуется тонкий слой сульфата свинца:
PbO+
Сульфат свинца в серной кислоте нерастворим и остается на поверхности электродов. Жидкий же электролит представляет собой водный раствор только серной кислоты.
Зарядка аккумулятора.
Для зарядки будущий анод внешней цепи аккумулятора соединяют с анодом генератора постоянного тока, а катод – с катодом.
На катоде внутренней цепи аккумулятора,
происходит «соперничество» между ионами
водорода ( из
и
 ),
с одной стороны и
),
с одной стороны и
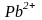 ионами – с другой. Здесь должен был
восстанавливаться водород, но величина
перенапряжения последнего на свинце
значительно больше, чем у свинца. На
катоде аккумулятора под воздействием
внешнего тока восстанавливаются ионы
.
ионами – с другой. Здесь должен был
восстанавливаться водород, но величина
перенапряжения последнего на свинце
значительно больше, чем у свинца. На
катоде аккумулятора под воздействием
внешнего тока восстанавливаются ионы
.

Свинец получается при этом в виде губчатой массы. Концентрация же серной кислоты в р-ре повышается за счет новых молекул , образующихся по предыдущему ур-нию.

Образовавшаяся соль подвергается гидролизу
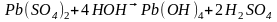
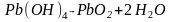
Суммарно:

Сопоставим между собой уравнения, получаем общее химическое ур-ние пр-са зарядки аккумулятора:
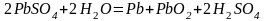
После достаточно долгого пропускания тока одна пластина заполняется губчатым свинцом, а другая – пористым слоем диоксида свинца.
Разрядка
Если полосы аккумулятора через достаточное
сопротивление замкнуть между собой, то
по внешней цепи пойдет электрический
ток, который будет направлен от Pb
к
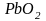 ,
т.е. в сторону выравнивания валентных
состояний свинца на обоих электродах.
,
т.е. в сторону выравнивания валентных
состояний свинца на обоих электродах.
А(+)


В пр-се работы аккумулятора свинец становится +2 – валентным. Концентрация же серной кислоты в электролите понижается.
Электрод, содержащий , является анодном внешней цепи. На нем идет катодный процесс восстановления +4 – валентного свинца до +2 – валентного.
К (+)
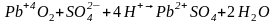
Суммарно
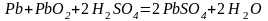
Суммарное ур-ние зарядке тоже, что и при разрядке, только наоборот. Это говорит о том, что пр-сы зар. и разр. аккум-ра укладывеются в одно общее ур-ние.
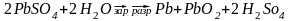
Щелочные аккумуляторы.
Наиболее распространены железо-никелевые. Роль губчатого свинца в данном случае играет спересованный порошок железа со специальными добавками, а роль диоксида свинца – гидроксид никеля (3), к которому добавлен чистый электролит.Электролитом служит р-р KOH.

Достоинства свинцового аккумулятора:
высокое КПД, высокое ЭДС, малое изменение ЭДС при разрядке и простоте конструкции.
Недостаток саморазряд при хранении и малой срок службы 2-5 лет.
Достоинства Fe-Ni? Cd-Ni относ большой срок службы до 10 лет, высокая механич. прочность. Недостаток невысокий КПД иЭДС. Щелочн аккум примин на телефон и телеграф станциях, в автомобилях, для освещения поездов и радиоустановок.
Для приготовления аккумуляторной кислоты возьмем 72% серную кислоту и 17% серную кислоту. Чтобы получить 250 мл 27% кислоты проведем следующие расчеты:
72% 10 x ρ72%=1.634 г/мл3
27%
17% 45 y ρ17%=1.12 г/мл3
55
10/55=x/(250*ρ27%)
24% - 1.174 г/мл3 28% - 1.206 г/мл3 4% - 0,032
28% - 27% = 1% 0,032 – 4% х – 1% х = 0,008
1,206 – 0,008 = 1,198 г/мл3
10/55=х/(250*1,198) х = 54,5 V = m / ρ = 54.5 / 1.634 = 33.2 мл
45/55=y/(250*1.214) y = 245 V = m / ρ = 245 / 1.12 = 218.75 мл
%ошибки = (ρn - ρT)*100% / ρT = 0%
Значит для приготовления 250 мл 27% раствора кислоты нужно смешать 33,2 мл 72% и 218,75 мл 17% кислоты.
Вопрос № 34.
Вопрос № 35
