
- •Вопрос 2 теория строения атома Бора
- •Вопрос 3 Правило Гейзенберга
- •Вопрос 4 квантовомеханическая модель атома Квантово-механическая модель атома
- •Вопрос 6 правило Клечковского Формулировка правила Клечковского
- •Вопрос 7 Основные характеристики атома
- •Вопрос 8-10. Электронная структура атома. Принцип Паули. Правило Хунда.
- •Вопрос 11 Закон термохимии
- •Закон Гесса: Тепловой эффект (∆н) химической реакции (при постоянных р и т) не зависит от пути её протекания, а зависит от природы и физического состояния исходных веществ и продуктов реакции.
- •Вопрос 12первый закон термодинамики
- •Вопрос 13 второй закон термодинамики
- •Вопрос 14 третий закон термодинамики
- •Вопрос15 Периодический закон Менделеева
- •Вопрос 16 электролиты. Теория диссоциации слабых электролитов
- •Вопрос 17 сильные электролиты теория сильных электролитов
- •Вопрос 18 закон разбавления Освальда
- •Вопрос 19 класс неорганических соединений
- •Вопрос 20 химическое равновесие. Его смещение принцы Ле-шателье
- •Смещение химического равновесия
- •Вопрос 21 законы неэлектролитов Закон Генри и осмоСа
- •Вопрос 23 Гидролиз соли по катиону
- •Вопрос 25 законы неэлектролитов. Закон Вант-Гофа, Рауля
- •Вопрос 26 зависимость скорости реакции от концентрации температуры и тд
- •Вопрос 34 ковалентная связь. Свойства
- •Вопрос 35Ионная связь
- •Вопрос 37 химическое равновесия обратимые и необратимые реакции
- •Смещение химического равновесия
- •Вопрос 38 Коррозия металлов виды корозии
- •Вопрос 39 Защита металлов от коррозии
- •Вопрос 40 Коррозия бетона.
- •Вопрос 42 Однокомпонентные системы. Фазовая диаграмма воды.
- •Вопрос 43. Двухкомпонентная система. Диаграммы с простой эвтектикой.
Вопрос 38 Коррозия металлов виды корозии
Корро́зия— это самопроизвольное разрушение металлов в результате химического или физико-химического взаимодействия с окружающей средой. В общем случае это разрушение любого материала, будь то металл или керамика, дерево или полимер. Причиной коррозии служит термодинамическая неустойчивость конструкционных материалов к воздействию веществ, находящихся в контактирующей с ними среде.
Виды коррозии: газовая коррозия; атмосферная коррозия; коррозия в неэлектролитах; коррозия в электролитах; подземная коррозия; биокоррозия; коррозия блуждающим током.
Коррозия металлов - происходящее на поверхности электрохимическое или химическое разрушение металлического материала. при коррозии металл окисляется с образованием ионов металла, которые при дальнейших превращениях дают различные продукты коррозии.
Химическая коррозия - взаимодействие поверхности металла с средой, не сопровождающееся возникновением электрохимических процессов на границе фаз. В этом случае взаимодействия окисление металла и восстановление окислительного компонента коррозионной среды протекают в одном акте.
Электрохимическая коррозия -Разрушение металла под воздействием возникающих в коррозионной среде гальванических элементов называют электрохимической коррозией.
Вопрос 39 Защита металлов от коррозии
Все методы защиты металлов от коррозии делятся на следующие группы:
а) легирование металлов - При легировании в состав сплава вводят компоненты, вызывающие пассивность металла. В качестве таких компонентов применяют хром, никель, вольфрам и т.д;
б) защитные покрытия (металлические: 1)чистые металлы (Zn, Al, Cu, Cr и др.) 2) сплавы (бронза, латунь и др.). При коррозии: катодные и анодные покрытия. Катодные - положительное значение (на стали (Сu, Ni, Аl) Анодные - отрицательный потенциал, чем потенциал основного металла( цинк на стали). Неметаллические - неорганические и органические. Защитное действие этих покрытий сводится в основном к изоляции металла от окружающей среды. Неорганических - неорганические эмали, оксиды металлов, соединения хрома, фосфора и др. Органические -лакокрасочные покрытия, покрытия смолами, пластмассами, полимерными пленками, резиной.);
в) электрохимическая защита-основан на торможении анодных или катодных реакций коррозионного процесса. Осуществляется присоединением защищаемой конструкции металла с более отрицательным значением электродного потенциала , а также катодной или анодной поляризацией за счет приложенного тока. Наиболее применима в коррозионных средах с хорошей ионной электрической проводимостью. Катодная защита используется для защиты от коррозии подземных и морских трубопроводов, подводным лодкам. Анодная защита применима к металлам и сплавам, способным легко пассивироваться(замедление коррозии) при смещении их потенциала в положительную сторону (Ni, Fе, Сr, Тi, Zr и др.). Анодную защиту применяют, например, для предотвращения коррозии нержавеющих сталей при контакте с серной кислотой.
г) изменение свойств коррозионной среды- уменьшают концентрацию опасных компонентов в коррозионном отношении. Например, в нейтральных средах коррозия обычно протекает с поглощением кислорода. Его удаляют деаэрацией (кипячение) или восстанавливают с помощью соответствующих восстановителей (сульфиты, гидразин )
д) рациональное конструирование изделий- исключает или сокращает число и размеры опасных участков в изделиях или конструкциях (сварных швов, узких щелей),а также предусматривать специальную защиту металла этих участков от коррозии.
Вопрос 41 Фазовые равновесия. Правило фаз Гиббса
Равнове́сие фаз в термодинамике — состояние, при котором фазы в термодинамической системе находятся в состоянии теплового, механического и химического равновесия.
Типы фазовых равновесий:
1-Тепловое равновесие (все фазы вещества в системе имеют одинаковую температуру).
2-Механическое равновесие (равенство давлений по разные стороны границы раздела соприкасающихся фаз).
3-Химическое равновесие (равенство химических потенциалов всех фаз вещества)
|
Рассмотрим химически однородную систему (состоящую из частиц одного типа). Пусть в этой системе имеется граница раздела между фазами 1 и 2. Как было указано выше, для равновесия фаз требуется равенство температур и давлений на границе раздела фаз. Известно (см. статью Термодинамические потенциалы), что состояние термодинамического равновесия в системе с постоянными температурой и давлением соответствует точке минимума потенциала Гиббса.
Потенциал Гиббса такой системы будет равен
![]() ,
,
где μ1 и μ2 — химические потенциалы, а N1 и N2 — числа частиц в первой и второй фазах соответственно.
При этом сумма N = N1 + N2 (полное число частиц в системе) меняться не может, поэтому можно записать
![]() .Предположим,
что
.Предположим,
что
![]() ,
для определенности,
,
для определенности,
![]() .
Тогда, очевидно, минимум потенциала
Гиббса достигается при
.
Тогда, очевидно, минимум потенциала
Гиббса достигается при
![]() (все
вещество перешло в первую фазу).
(все
вещество перешло в первую фазу).
Таким образом, равновесие фаз возможно только в том случае, когда химические потенциалы этих фаз по разные стороны границы раздела равны:
![]() .
.
Уравнение Клапейрона — Клаузиуса
Основная статья: Уравнение Клапейрона—Клаузиуса
Из условия равновесия фаз можно получить зависимость давления в равновесной системе от температуры. Если говорить о равновесии жидкость — пар, то под давлением понимают давление насыщенных паров, а зависимость P = P(T) называется кривой испарения.
Из условия равенства химических потенциалов следует условие равенства удельных термодинамических потенциалов:
![]() ,
,
где
![]() ,
Gi — потенциал Гиббса i-й фазы, mi — её
масса.
,
Gi — потенциал Гиббса i-й фазы, mi — её
масса.
Отсюда:
![]() ,
,
а значит,
![]() ,
,
где v1 и s1 — удельные объем и энтропия фаз. Отсюда следует, что
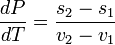 ,
,
и окончательно
![]() ,
,
где q — удельная теплота фазового перехода (например, удельная теплота плавления или удельная теплота испарения).
Последнее уравнение называется уравнением Клапейрона — Клаузиуса.
Правило фаз Гиббса
Рассмотрим теперь систему, вообще говоря, химически неоднородную (состоящую из нескольких веществ). Пусть k — число компонентов (веществ) в системе, а n — число фаз. Условие равновесия фаз для такой системы можно записать в виде системы из k(n − 1) уравнений:
Здесь—
химический
потенциал для i-го компонента в j-й
фазе. Он однозначно определяется
давлением, температурой и концентрацией
каждого компонента в фазе. Концентрации
компонетнов не независимы (их сумма
равна 1). Поэтому рассматриваемая система
уравнений содержит
![]() неизвестных
(n(k − 1) — концентрации компонентов в
фазах, плюс температура и давление).
неизвестных
(n(k − 1) — концентрации компонентов в
фазах, плюс температура и давление).
Система разрешима, вообще говоря, если число уравнений не превышает числа неизвестных (система, не удовлетворяющая этому условию, также может быть разрешима, однако это исключительный случай, с которым в физике можно не считаться). Поэтому
![]() ,
,
отсюда
![]() ,
,
то есть число фаз в равновесной системе может превышать число компонентов не более, чем на два.
Последнее неравенство называется правилом фаз Гиббса. В частном случае для однокомпонентной (химически однородной системы) оно превращается в условие
![]() .
.
