
Экзаменационный билет №24.
Взаимное влияние атомов в молекуле и его природа. Индуктивный и Мезомерный эффекты.
Моносахариды. Способы получения и химические свойства. Отдельные представители.
Алкены. Химические свойства: реакции гидратации, гидрирования, гидрогалогенирования, окисления на примере пропилена.
Взаимное влияние атомов в молекуле и его природа.
В органической химии известно огромное количество фактов, которые с несомненностью указывают на то, что атомы в молекулах или группы атомов взаимно влияют друг на друга. Различают взаимное влияние непосредственно связанных атомов и взаимное влияние атомов, непосредственно между собою не связанных.
Взаимное влияние непосредственно связанных атомов может быть иллюстрировано на примере четыреххлористого кремния SiCl4 и четыреххлористого углерода СCl4. Атомы хлора в этих соединениях резко отличаются по реакционной способности Так, например, хлор в SiCl4 при действии воды с чрезвычайной легкостью замещается на гидроксил, а хлор в ССl4 в таких условиях на гидроксил не обменивается. Причина такого различия кроется в различном влиянии, оказываемом кремнием и углеродом на непосредственно связанные с ними атомы галоида. В свою очередь, атомы хлора оказывают определенное влияние на атомы углерода и кремния.
Взаимное влияние оказывают друг на друга также и непосредственно не связанные атомы. Так, например, водород в цианистом водороде Н—C≡N по химическому характеру заметно отличается от водорода в метане Н—СН3, хотя в обоих случаях он непосредственно связан только с углеродом. Здесь изменение характера водорода обусловлено различным влиянием атомов, связанных с ним через посредство углерода (атома азота в одном случае и атомов водорода в другом).
Естественно, что, сравнивая только два вещества, нельзя проследить двухстороннее влияние атомов друг на друга. Так, при сравнении Н—CN и Н—СН3 обнаруживается только влияние атома азота и атома водорода на химический характер непосредственно не связанного с ними атома водорода.
Остается нерешенным вопрос о том, как в свою очередь влияет рассмотренный атом водорода на атом азота HCN и на остальные атомы водорода СН4. Для того чтобы стала очевидной взаимность влияния атомов или групп атомов, необходимо сравнивать большее число соединений. Так, например, чтобы показать наличие взаимного влияния гидроксильной и карбонильной групп в молекуле жирной кислоты, необходимо сравнить, по меньшей мере, три соединения:
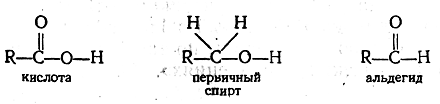
Сравнивая кислоту с первичным спиртом, мы убеждаемся, что характер гидроксильного водорода при переходе от спирта к кислоте изменился (легкость диссоциации, способность замещаться не только щелочными, но и другими металлами и т. п.). Такое изменение обусловлено заменой двух водородных атомов первичного спирта у атома углерода, с которым связан гидро-ксил, на атом кислорода и, следовательно, влиянием карбонильной группы на гидроксильную группу. С другой стороны, сравнивая альдегид и кислоту, мы обнаруживаем, что при замене атома водорода в альдегиде на гидроксильную группу изменяется характер карбонильной группы; последняя в кислоте становится менее реакционноспособной (не дает большинства реакций, типичных для карбонильной группы).
Вопрос о взаимном влиянии атомов, в том числе непосредственно не связанных, впервые принципиально поставил А. М. Бутлеров. Уже в 1861 г., дав понятие химического строения и природы вещества, А. М. Бутлеров писал: «...дальнейшее развитие выраженного здесь воззрения укажет, насколько химические свойства веществ зависят от химического строения, насколько высказанное правило недостаточно и какое взаимное влияние могут оказывать два атома, находящиеся внутри одной и той же химической частицы, но химически не действующие непосредственно друг на друга?».
Возвращаясь к этому вопросу, А. М. Бутлеров в 1879 г. указывал: «Если водород и хлор, — положим, по два атома каждого, — связаны с атомом угля, то из этого действительно следует, что они здесь не зависят один от другого в той степени, как от угля, между ними нет той зависимости, той связи, какая существует в частице соляной кислоты; как хлор, так и водород зависят здесь от угля приблизительно так же, как в частице СН4 и в частице ССl4. Но следует ли из этого, что в соединении СН2Cl2 между водородом и хлором нет никакой зависимости? Я отвечаю на это решительным отрицанием. Напротив, известная зависимость, хотя несравненно менее тесная, чем в хлороводороде,— зависимость другой категории, — между ними несомненно существует».
Поставленная А. М. Бутлеровым проблема взаимного влияния атомов была развита его учеником — Владимиром Васильевичем Марковниковым, который в 1869 г. защитил свою знаменитую диссертацию «Материалы по вопросу о взаимном влиянии атомов в химических соединениях». В. В. Марковников писал:
«Вопрос о влиянии элементарных атомов на направление химических реакций сложного тела принадлежит к числу самых животрепещущих вопросов современной химии и, как уже заметно, овладевает более и более вниманием химиков. Он должен был естественно возникнуть, как скоро большинством было усвоено учение о химическом строении, и является непосредственным продолжением и дальнейшим развитием этого учения».
Основываясь на большом экспериментальном материале, В. В. Марковников дает в своей диссертации общую формулировку закона взаимного влияния атомов:
«Если характер каждого сложного тела обусловливается характером и количеством его составных частей, то, в свою очередь, ...характер каждого из составляющих сложное тело элементарных паев обусловливается свойствами того элемента, с которым он вошел в соединение, и наоборот... Влияние ослабляется по мере удаления их друг от друга в общей цепи химического действия».
В. В. Марковников высказал ряд положений, оказавшихся чрезвычайно важными для дальнейшего развития органической химии как в теоретическом, так и в практическом отношении.
Таковы знаменитые «правила Марковникова» о порядке присоединения галоидоводородов и хлорноватистой кислоты к несимметрично построенным непредельным углеводородам, положения о большей легкости замещения атома водорода при третичном углеродном атоме сравнительно с атомами водорода у вторичного и первичного углеродных атомов и атома водорода при вторичном углеродном атоме сравнительно с водородным атомом у первичного углеродного атома. Таково положение о том, что при галоидировании карбоновых кислот в первую очередь замещается на галоид α-водородный атом. Эти положения В. В. Марковников во многих случаях подтвердил экспериментально.
Основные положения и следствия теории химического строения могут быть кратко сформулированы следующим образом:
1. В молекулах веществ существует определенная последовательность химической связи атомов, которая и носит, согласно А. M. Бутлерову, название химического строения.
2. Химические свойства вещества определяются составом и химическим строением его молекул.
3. Различное химическое строение при одном и том же составе и молекулярном весе вещества обусловливает явление изомерии.
4. Гак как при отдельных реакциях изменяются не все, а только некоторые части молекулы, то, изучая продукты химических превращений вещества, можно установить его химическое строение.
5. Химический характер (т. е. реакционная способность) атомов, входящих в молекулу, меняется в зависимости от того, с какими атомами они связаны в данной молекуле. Это изменение химического характера обусловливается главным образом взаимным влиянием непосредственно связанных атомов. Взаимное влияние атомов, не связанных непосредственно, обычно проявляется значительно слабее.
1.2. Индуктивный и Мезомерный эффекты.
