
- •Тема 1: Предмет физики конденсированного состояния (фкс)
- •Тема 2: Классификация твёрдых тел. Типы связи.
- •2.1. Классификация твёрдых тел
- •2.2. Типы связи
- •2.3. Энергия связи
- •2.4. Молекулярные кристаллы
- •2.5. Ионные кристаллы
- •2.6. Ковалентные кристаллы
- •2.7. Металлы
- •Тема 3: Структура твёрдых тел
- •3.1. Кристаллические решётки. Трансляционная симметрия
- •3.2. Решётки Браве
- •3.3. Индексы Миллера
- •2.А. Осью симметрии (простой или поворотной) называется линия, при повороте вокруг которой на некоторый определённый угол, фигура совмещается сама с собой.
- •3.4.1. Пространственные группы
- •3.5. Дифракция в кристаллах
- •3.6. Обратная решётка
- •3.7. Зоны Бриллюэна
- •Тема 4: Дефекты кристаллического строения
- •4.1. Классификация дефектов
- •4.2. Точечные дефекты
- •4.2.1. Равновесная концентрация дефектов
- •4.2.2. Условие электронейтральности. Дефекты Шоттки и Френкеля
- •4.2.3. Центр окраски
- •4.2.4. Радиационные дефекты
- •4.3. Дислокации
- •4.3.1. Краевая дислокация
- •4.3.2. Винтовая дислокация
- •4.3.3. Подвижность дислокаций
- •4.4. Контур и вектор Бюргерса
- •4.5. Энергия дислокации
- •4.6. Источники дислокации
- •Тема 5: Энергетический спектр кристаллов.
- •5.1. Описание энергетического состояния кристалла при помощи газа квазичастиц. Примеры квазичастиц.
- •Адиабатическое приближение Борна-Оппенгеймера.
- •Валентная аппроксимация
- •Одноэлектронное приближение
- •5.3. Свойство волнового вектора электрона в кристалле
- •5.4. Энергетический спектр электрона в кристалле. Модель Кронега-Пенни.
- •5.5. Заполнение зон электронами. Металлы. Диэлектрики. Полупроводники
- •5.6. Эффективная масса электрона. Свободный электрон.
- •Тема 6: Тепловые свойства тт. Электронный газ Ферми.
- •Тема 7: Полупроводники
- •7.1.1. Донорные примеси
- •7.1.2. Акцепторные примеси
- •7.2. Собственная проводимость полупроводников
- •7.3. Проводимость примесных полупроводников
- •7.4. Свойства твёрдых тел в сильных электрических полях
- •7.4.1. Разогрев электронного газа
- •7.4.2. Эффект Ганна.
- •7.4.3. Ударная ионизация
- •7.4.4. Эффект Зинера
- •Тема 8: Диэлектрики
- •8.1. Основные механизмы проводимости в диэлектриках.
- •8.2. Поляризация диэлектриков
- •8.2.1. Электронная упругая поляризация.
- •12 И 13 декабря студенческое анкетирование в 10:00 3-02
- •8.2.2. Ионная упругая поляризация
- •8.2.3. Дипольная, упругая и тепловая поляризации
- •8.2.4. Ионная тепловая поляризация
- •8.2.5. Электронная тепловая поляризация
- •8.3. Пьезоэлектрический эффект.
- •8.4. Пироэлектрический эффект
- •8.5. Сегнетоэлектрики
- •Тема 9: Оптические свойства твёрдых тел
- •9.1. Виды взаимодействия света с твёрдым телом
- •9.2. Оптические константы
- •9.3. Поглощение света кристаллами
- •9.3.1. Собственное поглощение
- •Тема 10: Механические свойства твёрдых тел
- •10.2. Упругая деформация
- •Тема 11: Сверхпроводимость
- •11.1. Свойства сверхпроводников
- •4 Класса дефектов – 8 свойств сверхпроводников. Зонное строение металлов (полупроводников). Перечисление типов дефектов, типы частиц.
2.5. Ионные кристаллы
Ионные кристаллы представляют собой
соединения с преобладающим ионным
характером химической связи, в основе
которой лежит электростатическое
взаимодействие между заряженными
ионами.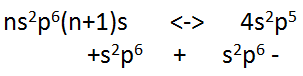
Типичные представители ионных кристаллов:
галогениды щелочных металлов (NaCl,
KCl, etc). При
образовании кристаллов типа NaCl
атомы галогенов (Cl, F,
Br), обладающие большим
сродством к электрону захватывают
электроны щелочных металлов (K,
Na, Li). При
этом образуются положительные и
отрицательные ионы с электронными
оболочками s2p6.
В результате кулоновского притяжения
анионов и катионов происходит перекрытие
6 внешних р орбиталей и образуется
решётка типа NaCl.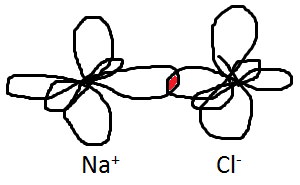
Лекция № 3 от 30.09.2011
К ионным кристаллам относятся большинство диэлектриков. Электропроводность ионных кристаллов при комнатной температуре на 20 порядков меньше электропроводности металлов. Электропроводность диэлектриков осуществляется в основном ионами. В ионных кристаллах притяжение обусловлено кулоновским взаимодействием между заряженными ионами. Кроме притяжения существует также отталкивание, обусловленное так же отталкиванием одноимённых зарядов. В условиях, когда существуют и силы притяжения, и силы отталкивания устойчивость ионных кристаллов объясняется тем, что расстояние между разноимёнными зарядами меньше, чем между одноимёнными, поэтому силы притяжения преобладают над силами отталкивания. Запишем выражение для энергии взаимодействия между двумя ионами i и j, находящимися на расстоянии rij в кристалле, образованном из ионов с зарядами Z1e и Z2e:
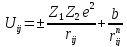
где первый член соответствует потенциалу притяжения, а второй – потенциалу отталкивания.
Пологая, что
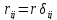 ,
,
 ,
где r – расстояние между
ближайшими ионами. Выполняя суммирование
по всем ионам, при условие что
,
где r – расстояние между
ближайшими ионами. Выполняя суммирование
по всем ионам, при условие что
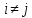 ,
получим потенциал взаимодействия i-го
иона со всеми остальными:
,
получим потенциал взаимодействия i-го
иона со всеми остальными:
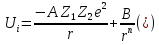
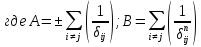
А и В – структурные суммы. Структурная сумма А называется постоянной Маделунга. Она зависит от типа кристаллической структуры и координационного числа. Координационное число – число ближайших соседей, окружающих данный атом. Знак в сумме выбирается в зависимости от заряда рассматриваемого иона. То есть δij определяет номер сферы ближайшей от выбранного иона соседа.
Рассмотрим пример вычисления А для кристалла NaCl:
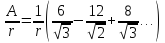
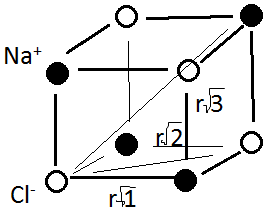
Это означает, что на расстоянии
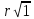 выбранного Cl-
находится 6 положительных Na,
на
выбранного Cl-
находится 6 положительных Na,
на
 – 12 отрицательных Cl, на
– 12 отрицательных Cl, на
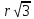 – 8 ионов Na. Запишем
выражение из (*) для полной энергии
кристалла, содержащего N
ионов:
– 8 ионов Na. Запишем
выражение из (*) для полной энергии
кристалла, содержащего N
ионов:

Чтобы найти равновесное состоянии при
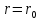 ,
продиффиринируем уравнение (поиск
экстремумов в точке):
,
продиффиринируем уравнение (поиск
экстремумов в точке):
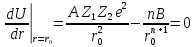
Отсюда можно выразить В:
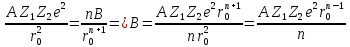
Которое необходимо подставить в формулу (**). Подставляя В в (**) мы можемм записать энергию сцепления ионного кристалла в расчёте на 1 пару ионов: (избавляемся от n)
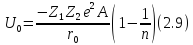
Это энергия связи ионного кристалла – формула Бора-Ланде.
2.6. Ковалентные кристаллы
К ковалентным кристаллам относятся твёрдые тела, кристаллическая структура которых образована за счёт ковалентной связи.
К ним относятся алмаз, кремний, германий, и алмаз подобные соединения. Как правило ковалентные кристаллы являются полупроводниками.
NB: Ковалентная связь имеет тоже происхождение, что и связь в гомополярных молекулах типа H2. Она обусловлена обменным электронным взаимодействием между атомами.
Для понимания сущности ковалентной связи рассмотрим механизм образования молекулы H2. Она образуется при взаимодействии двух атомов водорода. Один атом Н имеет 1s1 электрон в оболочке, так что ему не хватает 1 электрона для того, чтобы получилась полностью заполненная s оболочка. При сближении двух атомов Н возможно перекрытие электронных оболочек и переход электрона от 1-го атома ко 2-му. Так как электронные оболочки не полностью заполнены (на одной оболочке могут находиться 2 электрона с разными спинами), то оба электрона переходят к одному атому. В такой молекуле атомов водорода нет: в ней содержатся только составные части этих атомов – 2 протона и 2 электрона. Электроны становятся общими для обоих ядер, или говорят, что электроны коллективизируются обоими ядрами. При этом, поскольку электроны совершенно одинаковы, то при их обмене местами состояние системы не изменяется.
С квантово-механической точки зрения
состояние валентных электронов в атомах
описывается атомной волновой функцией
 ,
где r – расстояние от
центра ядра до места локализации
электрона. Если есть 2 электрона в двух
атомах, обозначаемых а и b,
то поведение электронов в этих атомах
будем описывать волновыми функциями
Ψa и
Ψb.
Поведение коллективизированных или
обобществлённых электронов будет
описываться молекулярной
волновой функцией. В качестве неё
можно выбрать Ψ, которая
описывает движение одного электрона в
общем поле атомов а и b.
Такую волновую функцию называют
молекулярной орбиталью
(МО). Она является линейной комбинацией
атомных орбиталей (ЛКАО):
,
где r – расстояние от
центра ядра до места локализации
электрона. Если есть 2 электрона в двух
атомах, обозначаемых а и b,
то поведение электронов в этих атомах
будем описывать волновыми функциями
Ψa и
Ψb.
Поведение коллективизированных или
обобществлённых электронов будет
описываться молекулярной
волновой функцией. В качестве неё
можно выбрать Ψ, которая
описывает движение одного электрона в
общем поле атомов а и b.
Такую волновую функцию называют
молекулярной орбиталью
(МО). Она является линейной комбинацией
атомных орбиталей (ЛКАО):
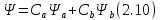
МО как ЛКАО. Здесь
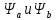 – атомные волновые функции / АО,
– атомные волновые функции / АО,
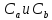 – const, характеризующие
долю участия в молекулярной орбитали
каждой из орбиталей.
– const, характеризующие
долю участия в молекулярной орбитали
каждой из орбиталей.
Для решения задачи о поведении
коллективизированных электронов
решается стационарное уравнение
Шрёдингера
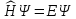 ,
где гамильтониан
,
где гамильтониан
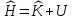 ,
где U – потенциальная
энергия системы, Е – полная энергия
системы,
,
где U – потенциальная
энергия системы, Е – полная энергия
системы,
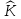 – кинетическая энергия. Оператор
– кинетическая энергия. Оператор
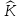 состоит из:
состоит из:
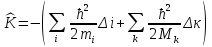
где mi – суммирование по всем электронам, Mk – по ядрам, Δ – лапласиан.
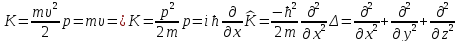
Так как масса ядер существенно больше массы электронов, то ядра в молекуле движутся значительно медленнее электронов. Предположение о малости скоростей движения ядер позволяет пренебречь в первом приближении оператором их кинетической энергии, а координаты ядер считать их фиксированными параметрами. Это приближение называется адиабатическим приближением.
Для случая симметричной двухатомной молекулы существует симметричная и антисимметричная волновые функции:
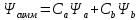
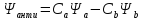
Двум собственным значениям волновой функции соответствует 2 значения энергии E1 и Е2 уравнения Шредингера.
NB: То есть при сближении
атомов и перекрытии их волновых функций
происходит расщепление их энергетического
уровня
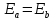 на 2 близко расположенных молекулярных
уровня энергии
на 2 близко расположенных молекулярных
уровня энергии
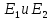 ,
при этом:
,
при этом:
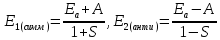
Это уровни энергии в молекуле. Здесь

Интеграл перекрытия, характеризующий степень перекрывания атомных волновых функций при взаимодействии (S < 1).
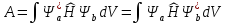
- обменный интеграл, представляющий собой дополнительную энергию взаимодействия, возникающую из-за перераспределения электронной плотности при перекрытии атомных волновых орбиталей (А < 0). При этом так как S < 1, а А < 0 уровень Есимм понижается, а уровень Еанти повышается относительно исходного уровня энергии Еа = Еb.
Переходя от молекулы H2 к кристаллам необходимо отметить следующее: основной характерной особенностью ковалентных кристаллов является то, количество ковалентных связей, образуемых каждым атомом со своими соседями ровно количеству неспаренных внешних электронов атома в свободном состоянии или в возбуждённом насыщенном. В этом смысле ковалентная связь является насыщенной. Дело в том, что атомы при взаимодействии могут возбуждать друг друга и производить распаривание электронов, то есть переводить один из спаренных электронов в свободную ячейку на незанятый энергетический уровень.
Рассмотрим атом углерода. У него 6
электронов. При объединении атомов
углерода (например в структуру алмаза)
один из 2s электронов
переходит в свободную 2р ячейку, и у
углерода на внешних оболочках получаются
4 неспаренных электрона. В результате
взаимного возбуждения все 4 электрона
находятся на так называемых гибридных
орбиталях (sp3-гибрид).
Это явление называется гибридизацией.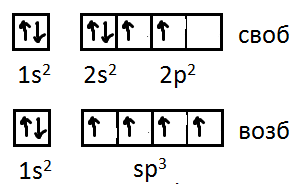
Наиболее характерной чертой ковалентной связи является её сильная направленность в пространстве, т.е. она образуется в тех направлениях, в которых локализуется электронная плотность. В следствии направленности связи ковалентные кристаллы обладают высокой твёрдостью и хрупкостью.
