
Раздел 4. Элементы статистической термодинамики
4.1 Основные положения статистической термодинамики. Условия равновесия. Начала термодинамики.
В данном разделе речь пойдет о термодинамических системах, причем под «термодинамикой» на этот раз понимаются действительно процессы, связанные с теплотой и передачей тепла. Будут рассматриваться новые системы, в которых, в отличие от рассматриваемых ранее, возможен обмен частицами.
Нулевое
начало.
Если ТДС
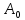 находится в равновесном состоянии с
системами
находится в равновесном состоянии с
системами
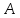 и
и
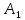 ,
то тогда система
,
то тогда система
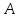 находится в равновесном состоянии с
системой
находится в равновесном состоянии с
системой
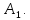
 Это
интуитивно понятно и, более того, может
быть подкреплено чисто математическими
выкладками:
Это
интуитивно понятно и, более того, может
быть подкреплено чисто математическими
выкладками:
 тогда
тогда
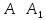
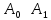
Также данное начало можно объяснить при помощи статистической физики:
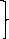

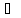

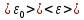 тогда
тогда
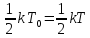
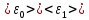

Системы
стремятся к равновесному состоянию,
если
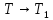 (это еще необходимо показать, но опять
же интуитивно понятно)
(это еще необходимо показать, но опять
же интуитивно понятно)
Первое начало. Закон сохранения энергии.
Рассмотрим
всю энергию системы (обозначим ее как
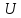 )
)
В самом общем случае она может складываться из множества компонент:
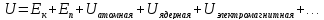
Мы
же остановимся на первых двух слагаемых:
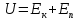
Возьмем
идеальный газ. Тогда состояние этой
системы подчиняется уравнению
Менделеева-Клапейрона:
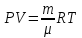
Возьмем
один моль вещества, то есть
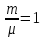 .
Тогда:
.
Тогда:
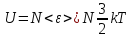
что
пропорционально температуре
 .
.
Отсюда
верно следующее:
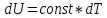
Из
уравнения Менделеева-Клапейрона
получаем:

Первое слагаемое есть некоторая работа, второе – некоторое количество тепла.
Количество
тепла
– это изменение внутренней энергии
термодинамической системы без совершения
работы (чтобы исключить работу, необходимо,
чтобы
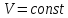 )
)
Таким образом, первое начало термодинамики будет выглядеть следующим образом:
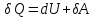
Или:
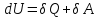
Второе начало (оно служит именно для того, чтобы предугадать направление изменения состояния системы). Это начало накладывает ограничения на направление термодинамических процессов, запрещая самопроизвольную передачу тепла от менее нагретых тел к более нагретым.
В классической физике было множество формулировок второго начала в различных областях, в том числе и утверждение о том, что вечный двигатель невозможен.
4.2 Термодинамические процессы. Превращение тепла в работу. Циклические процессы. Энтропия и энергия. «Энтропийная» формулировка второго начала термодинамики. Энтропия и вероятность, статистический смысл энтропии. Парадокс Максвелла. Информационный смысл энтропии.
В
начале 19-го века перед учеными встал
вопрос о том, можно ли создать идеальный
термодинамический цикл, чей КПД был бы
максимальным. Такой цикл был найден
военным инженером Сади Карно.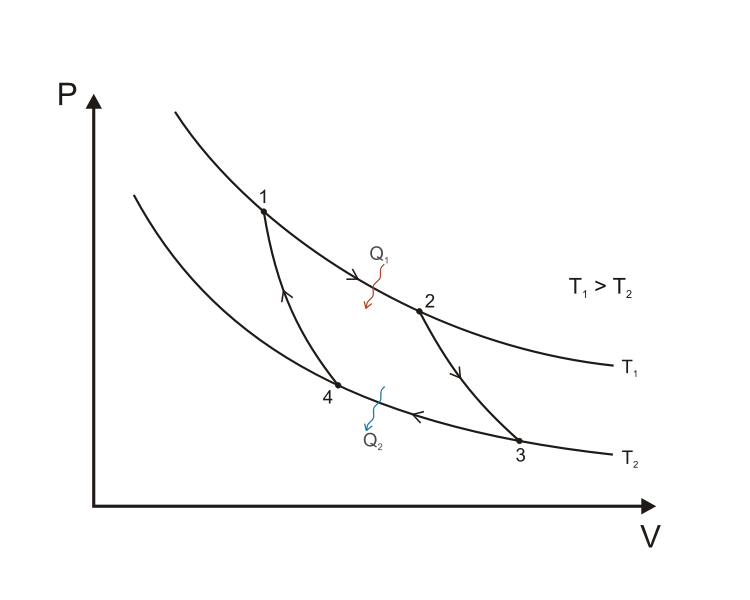
Описание цикла Карно:
-
Изотермическое расширение. В начале процесса рабочее тело имеет температуру TH, то есть температуру нагревателя. Затем тело приводится в контакт с нагревателем, который изотермически (при постоянной температуре) передаёт ему количество теплоты QH. При этом объём рабочего тела увеличивается.
-
Адиабатическое (изоэнтропическое) расширение. Рабочее тело отсоединяется от нагревателя и продолжает расширяться без теплообмена с окружающей средой. При этом его температура уменьшается до температуры холодильника.
-
Изотермическое сжатие. Рабочее тело, имеющее к тому времени температуру TX, приводится в контакт с холодильником и начинает изотермически сжиматься, отдавая холодильнику количество теплоты QX.
-
Адиабатическое (изоэнтропическое) сжатие. Рабочее тело отсоединяется от холодильника и сжимается без теплообмена с окружающей средой. При этом его температура увеличивается до температуры нагревателя.
Несмотря на то, что Карно в свое время лишь постулировал то, что КПД данного цикла будет максимальным, дальнейшие исследования показали, что это действительно так, причем:
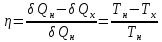
Для
любых других циклов значение величины
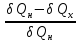 оказалось меньше, чем для цикла Карно.
оказалось меньше, чем для цикла Карно.
Исследуем цикл Карно.
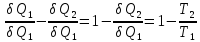
Отсюда
следует, что
 для цикла Карно
для цикла Карно
Энтропия
– это
функция параметров состояния
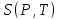 ,
дифференциал которой равен
,
дифференциал которой равен
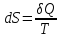 – то есть получаемой системой теплоте.
– то есть получаемой системой теплоте.
Вообще
говоря,
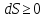 в изолированной системе, поскольку в с
абсолютной точки зрения температура
всегда больше нуля.
в изолированной системе, поскольку в с
абсолютной точки зрения температура
всегда больше нуля.
Отсюда Больцман сделал вывод о «тепловой смерти Вселенной».
Попытаемся расшифровать второе начало термодинамики с помощью статистической термодинамики. Введем статистический параметр, указывающий направление движения системы к равновесному состоянию.
Пусть
система
 находится в равновесном состоянии с
энергией
находится в равновесном состоянии с
энергией
 .
Обозначим
.
Обозначим
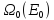 – число состояний, соответствующих
равновесному состоянию системы.
– число состояний, соответствующих
равновесному состоянию системы.
Разобьем
эту систему на две:
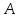 и
и
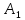 ,
им будут соответствовать
,
им будут соответствовать
 и <
и <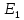 >,
>,
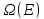 и
и
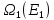 соответственно.
соответственно.
При
этом
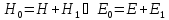
Найдем
вероятность
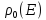 того, что система
того, что система
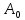 из всех состояний
из всех состояний
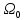 находится в состоянии
находится в состоянии
 ,
когда система
,
когда система
 имеет энергию
имеет энергию
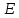 .
.
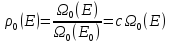 – эта
величина отличается от
– эта
величина отличается от
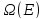 тем, что она может быть скомбинирована
с любыми другими состояниями системы.
тем, что она может быть скомбинирована
с любыми другими состояниями системы.
Тогда

Используем распределение Гиббса:
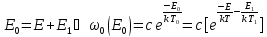
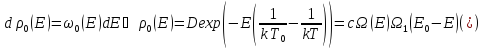
Таким
образом, условием для равновесия
является:

Логарифмируя
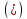 ,
получаем:
,
получаем:
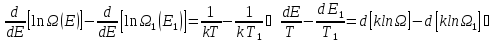
Так
как
 ,
то:
,
то:
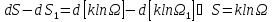
Таким образом, получили формулу энтропии (самой энтропии, а не ее дифференциала).
Рассмотрим
энтропию как меру неопределенности.
При
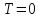
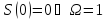 ,
то есть при абсолютном нуле у системы
может быть лишь одно состояние, нет
никакой неопределенности. Если же
энтропия растет, то число состояний
увеличивается и, следовательно, система
становится более неопределенной.
,
то есть при абсолютном нуле у системы
может быть лишь одно состояние, нет
никакой неопределенности. Если же
энтропия растет, то число состояний
увеличивается и, следовательно, система
становится более неопределенной.
Что
касается информационной составляющей
энтропии, то было предложено видоизменить
ее формулу следующим образом:
 ,
если
,
если
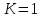 ,
то информация измеряется в натах, если
же
,
то информация измеряется в натах, если
же
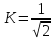 ,
то в битах, если же
,
то в битах, если же
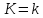 (то есть постоянной Больцмана), то в
физических единицах.
(то есть постоянной Больцмана), то в
физических единицах.
Таким образом, в энтропии скрыты энергетическая и информационная составляющие.
Парадокс Максвелла: предположим, сосуд с газом разделён непроницаемой перегородкой на две части: правую и левую. В перегородке отверстие с устройством (так называемый демон Максвелла), которое позволяет пролетать быстрым (горячим) молекулам газа только из левой части сосуда в правую, а медленным (холодным) молекулам — только из правой части сосуда в левую. Тогда через большой промежуток времени, "горячие" (быстрые) молекулы окажутся в правом сосуде, а "холодные" — "останутся" в левом. Таким образом получается, что демон Максвелла позволяет нагреть правую часть сосуда и охладить левую без дополнительного подвода энергии к системе. Энтропия для системы, состоящей из правой и левой части сосуда, в начальном состоянии больше, чем в конечном, что противоречит термодинамическому принципу неубывания энтропии в замкнутых системах. Парадокс разрешается, если рассмотреть замкнутую систему, включающую в себя демона Максвелла и сосуд. Для функционирования демона Максвелла необходима передача ему энергии от стороннего источника. За счёт этой энергии и производится разделение горячих и холодных молекул в сосуде, то есть переход в состояние с меньшей энтропией.
Иногда энтропию называют мерой превратимости тепла в работу.
