
МОЛЕКУЛЯРНАЯ СТАТИСТИЧЕСКАЯ ФИЗИКА
Раздел 1. Введение.
Предмет и методы молекулярной физики и термодинамики. Развитие представлений о строении вещества. Молекулярно-тепловое движение. Межмолекулярные силы. Равновесное состояние системы. Температура.
Молекулярная физика изучает термодинамические системы, состоящие из множества частиц (элементов). В современной физике под термодинамической системой понимают не некую систему, в которой происходит изменение температуры (термо=температура + динамика), а любую материальную систему.
Существует два основных направления изучения в физике:
-
Микронаправление
В основе этого подхода лежит знание структуры элементов изучаемой системы, например, о молекулах, об атомах или даже о более мелких частицах. Используя законы физики, в том числе и механики, находятся общие законы поведения макросистем. В этом подходе используются модели – а именно, только общие законы и средние значения.
В рамках этого направления существуют различные методы изучения:
-
Динамический (механический) метод
Используются конкретные параметры, конкретные значения и т.п.
-
Статистический метод
Этот метод НЕ ИСПОЛЬЗУЕТ конкретных значений, в этом случае исследователя интересует распределения параметров. Поскольку если есть функция распределения некоего параметра (например, скорости):
 ,
где V
– вероятность, то можно найти среднее
значение этого параметра:
,
где V
– вероятность, то можно найти среднее
значение этого параметра:
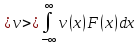
Таким
образом, каждый параметр, характеризующий
состояние системы, можно усреднить:
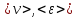 …
(
…
(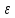 - энергия системы)
- энергия системы)
К плюсам этого метода можно отнести:
- можно применять любые законы, не только общие (в том числе и квантовые)
- этот метод позволяет предвидеть то, как будут протекать процессы в заданной системе с определенной вероятностью
-
Феноменальный подход
В
основе этого подхода лежит эксперимент
и использование макропараметров –
давления (p),
объема (V),
температуры (T),
массы (m),
количества вещества ( )…
Затем экспериментально находятся
взаимодействия между этими макропараметрами,
при этом не используется никаких моделей.
При помощи такого подхода был выведен
закон Менделеева-Клапейрона:
)…
Затем экспериментально находятся
взаимодействия между этими макропараметрами,
при этом не используется никаких моделей.
При помощи такого подхода был выведен
закон Менделеева-Клапейрона:
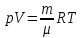 ,
где
,
где
 – молярная масса,
– молярная масса,
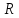 – универсальная газовая постоянная.
– универсальная газовая постоянная.
Основные положения молекулярно-кинетической теории:
-
Все вещества состоят из атомов и молекул;
-
Эти атомы и молекулы находятся в непрерывном хаотическом движении, которое не прекращается ни при каких условиях
-
Атомы и молекулы взаимодействуют между собой с силами притяжения и отталкивания.
Помимо этих основных положений, для изучения статистической физики также пригодятся:
Закон
сохранения и превращения энергии:

Второй
закон Ньютона:
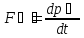
Закон
сохранения импульса:
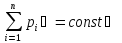
Теперь
более подробно остановимся на основных
положениях молекулярно-кинетической
теории. Первое положение, в общем-то,
очевидно. Что касается второго положения,
то тут необходимо заметить, что тепловое
движение и хаотичное движения по своей
сути не равносильны. Поскольку элементы
системы могут обмениваться энергией
(это интуитивно понятно), то энергию
хаотичного движения логично представить
в виде следующей формулы:
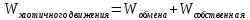 ,
причем вторая часть
,
причем вторая часть
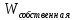 слагаемого не подлежит обмену
(следовательно,
слагаемого не подлежит обмену
(следовательно,
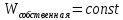 ),
а первая может быть взята/положена в
систему. Как раз первая составляющая -
),
а первая может быть взята/положена в
систему. Как раз первая составляющая -
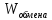 – и есть тепловая энергия.
– и есть тепловая энергия.
Рассмотрим
отдельно кинетическую энергию системы
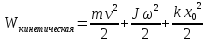 ,
причем
,
причем
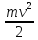 – составляющая, отвечающая за
поступательное движение,
– составляющая, отвечающая за
поступательное движение,
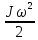 – за вращательное движение,
– за вращательное движение,
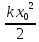 – за колебательное. Даже из этого
выражения можно выразить целых 9
независимых параметров, характеризующих
– за колебательное. Даже из этого
выражения можно выразить целых 9
независимых параметров, характеризующих
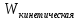 :
:
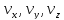

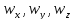
Для
данной системы эти независимые параметры
можно считать координатами. Если обобщить
данный факт, то можно ввести следующее:
число независимых переменных, определяющих
состояние системы, – есть число
степеней свободы.
Таким образом, если
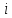 – число степеней свободы для одного
элемента, то
– число степеней свободы для одного
элемента, то
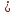 – число степеней свободы всей системы
(в ней
– число степеней свободы всей системы
(в ней
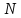 элементов). Таким образом, мы получаем
фазовое
пространство,
в котором каждая точка характеризуется
большим чистом координат (подробнее о
фазовом пространстве будет позднее).
Главное, что мы получаем крайне сложную
задачу по поиску закономерностей в
термодинамической системе.
элементов). Таким образом, мы получаем
фазовое
пространство,
в котором каждая точка характеризуется
большим чистом координат (подробнее о
фазовом пространстве будет позднее).
Главное, что мы получаем крайне сложную
задачу по поиску закономерностей в
термодинамической системе.
Перейдем
теперь к третьему пункту в основных
положениях МКТ – к силам. Формула
Леннарда-Джонсона описывает энергию
взаимодействия между молекулами: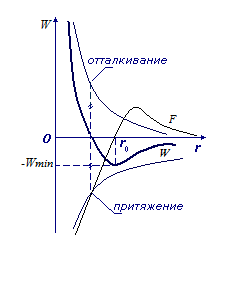
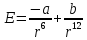 ,
где a
и b
– некоторые константы. Отсюда можно
найти силу
взаимодействия между молекулами:
,
где a
и b
– некоторые константы. Отсюда можно
найти силу
взаимодействия между молекулами:
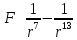 ,
где
,
где
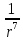 – как раз составляющая, отвечающая за
силы притяжения, а
– как раз составляющая, отвечающая за
силы притяжения, а
 – за силы отталкивания.
– за силы отталкивания.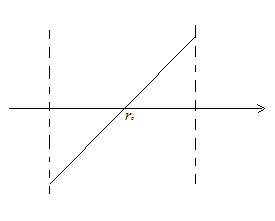
Рассмотрим
расстояния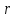 ,
близкие к
,
близкие к
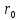 .
В окрестности этой точки график функции
.
В окрестности этой точки график функции
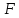 близок к отрезку прямой, проходящей
через
близок к отрезку прямой, проходящей
через
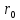 .
Таким образом:
.
Таким образом:

В
результате получаем, что характер
движения около
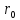 – колебательный. Это характерно для
твердых тел. В жидкости характер движения
молекул – колебательный с перескоком
в новое положение. В газе
– колебательный. Это характерно для
твердых тел. В жидкости характер движения
молекул – колебательный с перескоком
в новое положение. В газе
 и, следовательно, в газе молекула движется
поступательно от одного соударения до
другого.
и, следовательно, в газе молекула движется
поступательно от одного соударения до
другого.
Равновесное состояние ТДС. Температура.
ТДС находится в равновесном состоянии, если при неизменных внешних условиях она может находиться в этом состоянии сколь угодно долго.
Если
один из параметров, характеризующих
систему (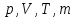 )
постоянен при неизменных внешних
условиях, то система равновесна по этому
параметру (речь как раз идет об
изопроцессах: при постоянной температуре
– изотерма, при постоянном давлении –
изобара и т.п.)
)
постоянен при неизменных внешних
условиях, то система равновесна по этому
параметру (речь как раз идет об
изопроцессах: при постоянной температуре
– изотерма, при постоянном давлении –
изобара и т.п.)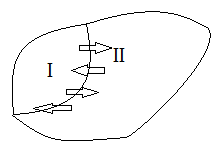
Если
все макропараметры неизменны и одинаковы
во всех точках системы, то замкнутая
система находится в равновесном
состоянии. Пусть имеется две
термодинамические системы, причем они
взаимодействуют только через линию
соприкосновения. Системы не могут
реагировать химически, не могут
распространяться одна на другую, не
могут обмениваться массой и энергией
движения, как единого целого. Таким
образом, можно обмениваться только
энергией теплового движения:
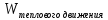 .
.
Статистическая
физика утверждает, что равновесное
состояние по
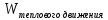 наступит, когда:
наступит, когда:
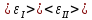 ,
где
,
где
 – энергия одной молекулы.
– энергия одной молекулы.
Например,
для идеального газа (математическая
модель газа,
в которой предполагается, что потенциальной
энергией взаимодействия молекул можно
пренебречь по сравнению с их кинетической
энергией,
между молекулами не действуют силы
притяжения или отталкивания, соударения
частиц между собой и со стенками
сосуда абсолютно
упруги,
а время взаимодействия между молекулами
пренебрежимо мало по сравнению со
средним временем между столкновениями)
будет верно:

Таким
образом, равновесный параметр -
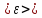 будет равен
будет равен
 .
.
Так
как
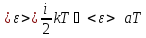 ,
то отсюда как раз и видна непосредственная
связь между средней энергией молекул
и температурой.
,
то отсюда как раз и видна непосредственная
связь между средней энергией молекул
и температурой.
Замечание: для установления состояния равновесия необходимо некоторое время. Если две термодинамические системы обмениваются энергией, то время сравнивания температур (а следовательно, и средних энергий молекул) называется временем релаксации. Например, необходимо некоторое время, чтобы получить точные данные при помощи термометра.
