
- •Загальна хімія
- •Загальні положення
- •Загальні правила роботи і техніка безпеки в лабораторії хіміЇ
- •Робота з небезпечними, токсичними, легкозаймистими і вогненебезпечними речовинами
- •Гасіння місцевої пожежі та палаючого одягу
- •Допомога при опіках
- •Визначення молярної маси еквівалента металу Запитання та задачі
- •Проведення досліду
- •Визначення молярної маси газоподібної речовини Запитання та задачі
- •Проведення досліду
- •Розрахунки:
- •Властивості оксидів та їх похідних Запитання та задачі
- •Проведення дослідів
- •Кількісний склад та приготування розчинів Запитання та задачі
- •Проведення дослідів
- •Електролітична дисоціація Запитання та задачі
- •Проведення дослідів
- •Гідроліз солей Запитання та задачі
- •Проведення дослідів
- •Ряд напруг металів Запитання та задачі
- •Проведення дослідів
- •Корозія металів Запитання та задачі
- •Проведення дослідів
- •Сполуки магнію та кальцію Запитання та задачі
- •Проведення дослідів
- •Твердість води Запитання та задачі
- •Проведення дослідів
- •Алюміній і його сполуки Запитання та задачі
- •Проведення дослідів
- •Сполуки кремнію Запитання та задачі
- •Проведення дослідів
- •Сполуки хрому Запитання та завдання
- •Проведення дослідів
- •Сполуки марганцю Запитання та завдання
- •Проведення дослідів
- •Залізо та його сполуки Запитання та завдання
- •Проведення дослідів
- •Азот. Фосфор Запитання і задачі
- •Проведення дослідів
- •Сірка та її сполуки Запитання та задачі
- •Проведення дослідів
- •Галогени Запитання та задачі
- •Проведення дослідів
- •Хімія в’яжучих речовин Запитання та задачі
- •Проведення дослідів
- •Список літератури
- •Тиск водяної пари рН2о при різних температурах
- •Фізичні величини та числові значення деяких констант:
- •Ряд напруг металів
- •Для нотаток
- •Загальна хімія
Твердість води Запитання та задачі
-
Походження твердості води, її вплив на властивості води. Класифікація природних вод за твердістю. Навести одиниці виміру твердості води.
-
Описати методи усунення тимчасової (карбонатної) твердості води.
-
Навести методи усунення постійної твердості води.
-
Скільки соди Na2CO3 треба для того, щоб пом’якшити 1 м3 води загальною твердістю 6,8 мг-екв?
-
При кип’ятінні 10 л води утворилося 5,5 г осаду карбонату кальцію. Якою була тимчасова (карбонатна) твердість води?
Проведення дослідів
Дослід 1. Приготування твердої води
У колбу наливають 20-30 мл вапняної води, стільки ж – дистильованої і додають 5-6 мл насиченого розчину сульфату кальцію. За допомогою апарату Кіппа в розчин пропускають вуглекислий газ. Осад, що утворився при подальшому пропусканні вуглекислого газу, повністю розчиняється. Записати рівняння реакцій.
Одержану тверду воду залишають для наступних дослідів.
Дослід 2. Видалення солей твердості
Наливають у чотири пробірки по 4-5 мл води, одержаної в першому досліді. Воду в одній пробірці нагрівають до кипіння. Чому виникло помутніння? Яка твердість усувається кип’ятінням? Складають рівняння реакції. В решту пробірок додають: в першу – розчин соди, в другу – вапняну воду і в третю – розчин фосфату натрію. Що відбувається в пробірках? Скласти рівняння реакцій в молекулярному та іонному виді.
Дослід 3. Визначення тимчасової (карбонатної) твердості води
В основі методу лежить реакція між соляною кислотою і гідрокарбонатами: Ca(HCO3)2 + 2HCl = CaCl2 + 2H2O + 2CO2↑
Тимчасова твердість дорівнює кількості соляної кислоти в одиницях мілімолярної концентрації еквівалента (мг-екв), що витрачена на титрування 1 л води.
Наливають в дві колби по 100 мл досліджуваної води і додають по 2-3 краплі метилоранжу. Воду в одній колбі залишають для контролю, а в другу колбу з бюретки краплинами додають розчин соляної кислоти з молярною концентрацією 0,1 моль/л, до тих пір, поки від однієї краплини кислоти забарвлення з жовтого не перейде в жовтогаряче (порівняйте із забарвленням води в контрольній колбі). Титрування проводять 2-3 рази; для розрахунків необхідно взяти середній результат. Оскільки реакції протікають між еквівалентними кількостями речовин, то, відповідно до закону еквівалентів, у взятому об’ємі води міститься така кількість гідрокарбонатів кальцію й магнію в одиницях мілімолярної концентрації еквівалента (мг-екв), скільки HCl міститься в об’ємі соляної кислоти, що був витрачений на титрування. Формула для визначення твердості води, мг-екв/л:
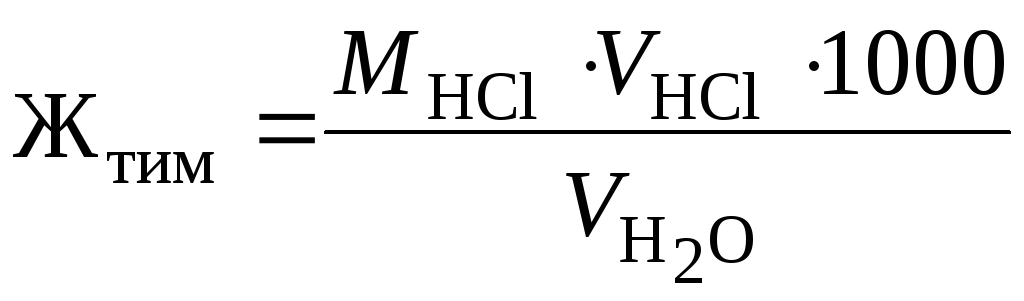 ,
,
де Жтим - карбонатна (тимчасова) твердість води;
МHCl - молярна концентрація розчину соляної кислоти;
VHCl – об’єм розчину HCl, використаний на титрування води (середнє значення з трьох вимірів);
VH2O – об’єм води, взятої для титрування.
Дослід 4. Якісне визначення іонів Ca2+ у воді
Беруть три однакові пробірки, в одну наливають 5 мл води, отриманої в досліді 1, в другу – 5 мл води з водогону, у третю – 5 мл дистильованої води. У кожну пробірку додають по 1 мг розчину NH4OH і по 2-3 мл розчину оксалату амонію (NH4)2C2O4. Порівнюють вміст пробірок. Де утворився осад? Записують рівняння реакцій.
Дослід 5. Якісне визначення іонів SO42- у воді
В одну пробірку наливають 5 мл води, отриманої в досліді 1, в другу – 5 мл з водогону і в третю – 5 мл дистильованої води. В кожну пробірку додають по 2-3 мл розчину хлориду барію. Де утворився осад? Записують рівняння реакцій.
Дослід 6. Дія мила на м’яку та тверду воду
Наливають в одну пробірку 5-6 мл води з водогону, а в другу – такий же об’єм дистильованої води. Додають в кожну пробірку піпеткою по 0,5 мл мильного розчину, збовтують вміст пробірок до зникнення піни. Після цього додають знову по 0,5 мл мильного розчину і знову збовтують. Так повторюють доти, доки не утвориться стійка піна. Яка кількість мильного розчину пішла на утворення стійкої піни в кожній пробірці? Чому?
Лабораторна робота №11
