
- •Загальна хімія
- •Загальні положення
- •Загальні правила роботи і техніка безпеки в лабораторії хіміЇ
- •Робота з небезпечними, токсичними, легкозаймистими і вогненебезпечними речовинами
- •Гасіння місцевої пожежі та палаючого одягу
- •Допомога при опіках
- •Визначення молярної маси еквівалента металу Запитання та задачі
- •Проведення досліду
- •Визначення молярної маси газоподібної речовини Запитання та задачі
- •Проведення досліду
- •Розрахунки:
- •Властивості оксидів та їх похідних Запитання та задачі
- •Проведення дослідів
- •Кількісний склад та приготування розчинів Запитання та задачі
- •Проведення дослідів
- •Електролітична дисоціація Запитання та задачі
- •Проведення дослідів
- •Гідроліз солей Запитання та задачі
- •Проведення дослідів
- •Ряд напруг металів Запитання та задачі
- •Проведення дослідів
- •Корозія металів Запитання та задачі
- •Проведення дослідів
- •Сполуки магнію та кальцію Запитання та задачі
- •Проведення дослідів
- •Твердість води Запитання та задачі
- •Проведення дослідів
- •Алюміній і його сполуки Запитання та задачі
- •Проведення дослідів
- •Сполуки кремнію Запитання та задачі
- •Проведення дослідів
- •Сполуки хрому Запитання та завдання
- •Проведення дослідів
- •Сполуки марганцю Запитання та завдання
- •Проведення дослідів
- •Залізо та його сполуки Запитання та завдання
- •Проведення дослідів
- •Азот. Фосфор Запитання і задачі
- •Проведення дослідів
- •Сірка та її сполуки Запитання та задачі
- •Проведення дослідів
- •Галогени Запитання та задачі
- •Проведення дослідів
- •Хімія в’яжучих речовин Запитання та задачі
- •Проведення дослідів
- •Список літератури
- •Тиск водяної пари рН2о при різних температурах
- •Фізичні величини та числові значення деяких констант:
- •Ряд напруг металів
- •Для нотаток
- •Загальна хімія
Визначення молярної маси еквівалента металу Запитання та задачі
-
Дати визначення хімічного еквівалента елемента.
-
Сформулюйте закон еквівалентів та запишіть його математичну формулу.
-
Визначити молярні маси еквівалентів наступних речовин: MnO2, Ca(OH)2, H2SO4, KMnO4, Al2(SO4)3.
-
З 1,3 г гідроксиду металу (ІІ) добуто 2,85 г сульфату цього металу. Вирахувати молярну масу еквівалента цього металу.
-
Привести до нормальних умов 1 л водню, взятого при температурі 25С і тиску 93,325 кПа.
-
Який об’єм водню, виміряного за нормальних умов, виділиться при взаємодії з кислотою 5 г металу (ІІ), молярна маса еквівалента якого дорівнює 20 г/моль?
Проведення досліду
Основою методу визначення молярної маси еквіваленту металу є реакція взаємодії цього металу з кислотою і вимірювання об’єму водню, що виділився, наприклад:
Zn +
2HCl(р)ZnCl2
+ H2![]()
Збирають лабораторну установку, схема якої зображена на рис.1 таким чином:
а
б h
Рис. 1. Прилад для визначення еквівалента металу об’ємним методом
-
У кристалізатор наливають до половини об’єму воду кімнатної температури. Циліндр місткістю 250 мл заповнюють водою “з верхом”, а потім надлишок води зрізують папером так, щоб у циліндр не потрапило повітря. Притримуючи папір, циліндр перевертають, занурюють у кристалізатор з водою та фіксують за допомогою штатива.
-
В колбу, за допомогою лійки, наливають кислоту. Кількість її повинна бути такою, щоб у положенні (а), яке зображене на рис. 1, кислота не потрапляла в горловину колби.
-
Колба закріплюється у штативі в положенні (а), як показано на рис.1.
-
Наважку металу вміщують в горловину колби, уникаючи контакту з кислотою. Колбу герметично закривають пробкою з відвідною трубкою.
-
Перевіряють герметичність колби з відвідною трубкою. Для цього кінець відвідної трубки занурюють у воду, а повітря в колбі нагрівають руками. Якщо при цьому у воду проходять бульбашки повітря, система герметична. Відвідну трубку підводять під циліндр.
-
Колбу закріплюють вертикально в лапці штативу (рис.1 положення б), метал падає у кислоту і в результаті взаємодії з нею утворюється водень, що потрапляє, витискаючи воду, у циліндр .
-
Коли водень перестає виділятись, відмічають склографом його нижній рівень в циліндрі. Вимірюють за допомогою лінійки висоту газового стовпа (h).
-
Прилад розбирають. У циліндр наливають води за об’ємом стільки, скільки було водню. Потім об’єм води вимірюють мірним циліндром, і таким чином знаходять об’єм одержаного водню (V).
-
Дані досліду записують у робочий журнал.
Дані досліду
Наважка металу m, мг.
Об’єм водню V, мл.
Висота стовпчика води в циліндрі h, мм.
Атмосферний тиск Р, кПа.
Температура повітря в лабораторії t, С.
Тиск водяної пари Р H2O, мм (див. дод. 1).
Розрахунки
-
Розрахуйте парціальний тиск водню в циліндрі, кПа:
![]()
![]() ,
кПа.
,
кПа.
-
Об’єм водню, що виділився, приводять до нормальних умов
(Р = 1 атм, або 101,3 кПа, Т=273 К):
![]() ,
мл.
,
мл.
-
Молярну масу еквівалента металу розраховують за формулою, що випливає із закону еквівалентів:
![]() ,
,
де 11200 мл – молярний об’єм еквівалента водню за нормальних умов.
-
Розраховують відносну похибку досліду, %:
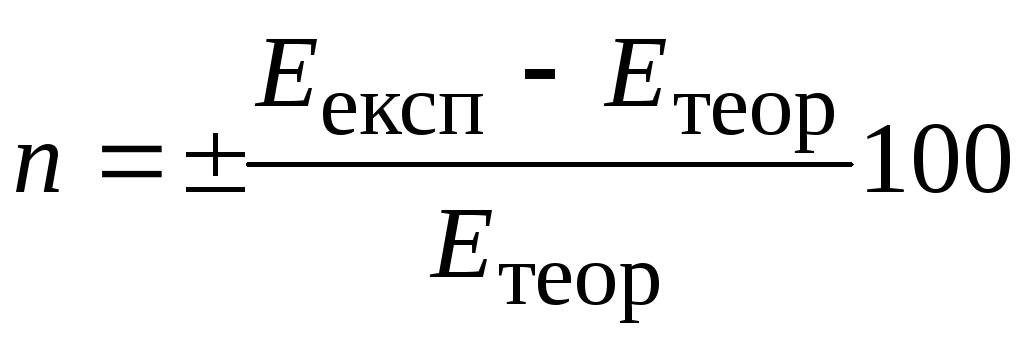 %.
%.
Лабораторна робота №2
