- •Содержание
- •Задачи по химии
- •1. Эквивалент. Закон эквивалентов.
- •5,6 Г железа эквивалентны 3,2 г серы,
- •28 Г металла эквивалентны 11,2 л водорода
- •2. Основные газовые законы.
- •3. Моль. Закон авогадро. Мольный объем газа
- •28 Г азота занимают объем 22,4 л ,
- •4.Определение молекулярных масс веществ в газообразном состоянии
- •0, 824 Г газа занимают объем 0,260 л ,
- •Вывод химических формул. Расчеты по химическим уравнениям
- •117 Г NaCl дают 22,4 л Сl , 100 г NaCl - X л Cl
- •6. Строение атома. Электронная структура атомов. Зависимость свойств элементов от строения их атомов
- •7. Химическая связь. Типы химической связи
- •8. Полярность молекул. Геометрическая структура молекул
- •9. Ионная связь. Поляризация ионов
- •10. Водородная связь. Межмолекулярное взаимодействие
- •11.Основные закономерности протекания химических реакций
- •11.1. Энергетика химических реакций.
- •11.2. Скорость химических реакций. Химическое равновесие
- •Изучение свойств водорода
- •1. Цель работы
- •2. Контрольные вопросы
- •3. Содержание работы и методические указания к ее выполнению
- •2. Наблюдать проведение следующих опытов и записать уравнения реакций.
- •3. В каждой окислительно—восстановительной реакции проставить степени окисления и записать полуреакции.
- •4. Написать названия соединений в химических реакциях.
- •Лабораторная работа №2 Галогены – р-элементы VII группы периодической системы д.И.Менделеева
- •1. Цель работы
- •2. Контрольные вопросы
- •3. Содержание работы и методические указания к ее выполнению
- •1. Изучить строение молекул ; .
- •2. Наблюдать проведение следующих опытов и записать уравнения реакций.
- •3. В каждой окислительно – восстановительной реакции проставить степени окисления и записать полуреакции.
- •4. Написать названия химических соединений, участвующих в реакциях.
- •Лабораторная работа № 3 Кислород и сера – р-элементы VI группы периодической системы д.И.Менделеева
- •1. Цель работы
- •2. Контрольные вопросы
- •3. Содержание работы и методические указания к её выполнению
- •1. Изучить строение молекул.
- •2. Наблюдать опыты и написать уравнения следующих реакций:
- •3. В каждой окислительно-восстановительной реакции проставить степени окисления и записать полуреакции.
- •4. Написать названия соединений в химических реакциях.
- •Лабораторная работа № 4 Элементы V группы периодической системы д.И.Менделеева
- •1. Цель работы
- •2. Контрольные вопросы
- •3. Содержание работы и методические указания к её выполнению
- •1. Изучить строение молекул.
- •2. Наблюдать опыты и написать уравнения следующих реакций:
- •3. В каждой окислительно-восстановительной реакции проставить степени окисления и записать полуреакции.
- •4. Написать названия соединений в химических реакциях.
- •Лабораторная работа № 5
- •1. Цель работы
- •2. Контрольные вопросы
- •3. Содержание работы и методические указания к ее выполнению
- •1. Изучить строение атомов и и молекул образуемых ими оксидов и кислот.
- •2. Наблюдать проведение следующих опытов и записать уравнения реакций:
- •3. В каждой окислительно-восстановительной реакции проставить степени окисления и записать полуреакции.
- •4. Написать названия соединений в химических реакциях.
- •5. Для реакций, в которых происходит гидролиз какого-либо продукта, написать уравнение гидролиза.
- •Лабораторная работа № 6 Электролиз
- •1. Цель работы
- •2. Контрольные вопросы
- •3. Содержание работы и методические указания к ее выполнению
- •1. Постепенно открывая гипертекстовые ссылки, указанные ниже, наблюдайте проведение опытов и запишите уравнения реакций для следующих процессов электролиза:
- •2. Составьте схемы процессов электролиза.
- •Литература
Лабораторная работа № 5
р-Элементы IV группы периодической системы Д.И. Менделеева
1. Цель работы
1. Изучить
электронное строение и свойства элементов
IV
группы главной А
подгруппы на примере типических элементов
углерода
![]() и кремния
и кремния
![]() .
.
2. На
примере соединений углерода проанализировать
образование
![]() -связей
и гибридизацию атомных орбиталей (
-связей
и гибридизацию атомных орбиталей (![]() ,
,
![]() ,
,
![]() ).
).
2. Контрольные вопросы
1. Охарактеризовать аллотропные модификации углерода и указать причину различия их свойств.
2. Какие типы гибридизации атомных орбиталей характерны для углерода?
3. В каких
случаях при горении угля образуется
оксид углерода (II)
-
![]() ?
?
4. Дать краткую характеристику кремнию, указав: а) электронное строение атома и его валентные возможности; б) химические свойства свободного кремния.
5. Описать свойства угольной кислоты.
6. Указать
тип гибридизации атомных орбиталей
кремния в молекулах
![]() и
и
![]() .
Полярны ли эти молекулы?
.
Полярны ли эти молекулы?
7. Водяной газ представляет собой смесь равных объемов водорода и оксида углерода (II). Найти количество теплоты, выделяющейся при сжигании 112 л водяного газа, взятого при нормальных условиях.
3. Содержание работы и методические указания к ее выполнению
На
«рабочем столе» ПК найдите значок
программы « 1C:
Химия». После загрузки программы, найдите
вкладку «Альбом» / «Элементы IV
группы:
![]() ,
,![]() ».
».
1. Изучить строение атомов и и молекул образуемых ими оксидов и кислот.
1.1.
Зарисовать электронное строение атомов
![]() и
и
![]() .
.
1.2.
Зарисовать структурную формулу молекулы
оксида кремния
![]() .
.
1.3.
Зарисовать структурную и геометрическую
формулы молекулы оксида углерода (II)
![]() .
.
1.4.
Зарисовать структурную и геометрическую
формулы молекулы оксида углерода (IV)
![]() .
.
1.5.
3арисовать структурную и геометрическую
формулы молекулы угольной кислоты
![]()
1.6.
Зарисовать структурную формулу молекулы
кремниевой кислоты
![]() .
.
2. Наблюдать проведение следующих опытов и записать уравнения реакций:
2.1. Взаимодействие карбида кальция с водой в присутствии индикатора фенолфталеина. Выделяется ацетилен.
2.2. Взаимодействие мрамора (или мела) с соляной кислотой. Выделяется углекислый газ.
2.3. Взаимодействие карбоната натрия с водой. Выделяется углекислый газ. Изменение среды со щелочной на кислую и вновь на щелочную.
2.4. Взаимодействие гидроксида кальция с угольной кислотой. Выделяется осадок карбоната кальция, который растворяется при избытке угольной кислоты.
2.5. Взаимодействие силиката натрия с соляной кислотой. Выделяется осадок кремниевой кислоты.
2.6. Промышленные методы получения оксида углерода (II).
2.6.1. Пропускание воздуха или углекислого газа через раскаленный уголь.
2.6.2. Газификация угля.
3. В каждой окислительно-восстановительной реакции проставить степени окисления и записать полуреакции.
4. Написать названия соединений в химических реакциях.
5. Для реакций, в которых происходит гидролиз какого-либо продукта, написать уравнение гидролиза.
Приложение
В IV
группу входят углерод
![]() ,
кремний
,
кремний
![]() ,
германий
,
германий
![]() ,
олово
,
олово
![]() и свинец
и свинец
![]() .
Электронная конфигурация невозбужденных
атомов элементов
.
Электронная конфигурация невозбужденных
атомов элементов
![]()
![]() (валентные
электроны), причем на р-орбиталях
находится 2 неспаренных электрона
(правило Гунда):
(валентные
электроны), причем на р-орбиталях
находится 2 неспаренных электрона
(правило Гунда):
![]()
![]()
|
|
|
|
|
|
В своих соединениях элементы IV-A- группы, имеют, как правило, две степени окисления: (+II) или (+IV). Устойчивость соединений со степенью окисления (+II) увеличивается от С к Рb, что подтверждается в частности изменением энергии Гиббса:
![]()
![]() 41
кДж
41
кДж
![]()
![]() 6
кДж
6
кДж
![]() ,
,
![]() 185
кДж
185
кДж
Из значений
![]() следует, что соединения
следует, что соединения
![]() (II) должны быть сильными
восстановителями, а соединения
(II) должны быть сильными
восстановителями, а соединения
![]() (IV) - сильными окислителями
(
(IV) - сильными окислителями
(![]() ,
,
![]() ).
).
Элементы IV - А
- группы в степени окисления (+IV)
образуют слабые кислоты (![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() ),
а со степенью окисления (+II)
– малорастворимые основания составов
),
а со степенью окисления (+II)
– малорастворимые основания составов
![]() ,
,
![]() ,
которые проявляют амфотерные свойства.
Устойчивость гидридов резко падает от
метана
,
которые проявляют амфотерные свойства.
Устойчивость гидридов резко падает от
метана
![]() (
(![]() 51
кДж/моль) к плюмбату
51
кДж/моль) к плюмбату
![]() .
Уже моносилан
.
Уже моносилан
![]() является эндотермическим соединением
(
является эндотермическим соединением
(![]() 57кДж/моль).
57кДж/моль).
Гидролиз всех тетрагалогенов термодинамически возможен:
![]()
![]() 380
кДж
380
кДж
![]()
![]() 278
кДж
278
кДж
У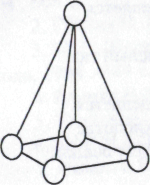 глерод,
кремний и германий имеют несколько
аллотропных модификаций, одной из
которых является модификация с атомной
кристаллической решеткой алмаза.
глерод,
кремний и германий имеют несколько
аллотропных модификаций, одной из
которых является модификация с атомной
кристаллической решеткой алмаза.
Алмаз - метастабильная модификация углерода. В его кристаллах каждый атом углерода окружен 4 такими же атомами, располагающимися в вершинах правильного тетраэдра.
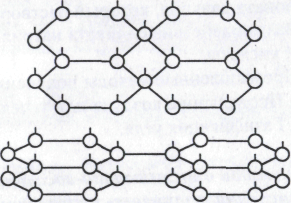 Графит
- стабильная аллотропная модификация
углерода со слоистой структурой,
состоящая из шестичленных бесконечных
колец.
Графит
- стабильная аллотропная модификация
углерода со слоистой структурой,
состоящая из шестичленных бесконечных
колец.
Кристаллическую решётку графита можно считать переходной между молекулярной и металлической решетками.
Кристаллическая
решётка третьей аллотропной модификации
углерода - карбина состоит из линейных
цепей. Расстояние между ними меньше,
чем между слоями графита, за счет более
сильного межмолекулярного взаимодействия.
Карбин образует кристаллы белого цвета.
У углерода допускают существование еще
двух малоизученных модификации
металлического углерода (углерод (III)
и углерода
![]() ).
Химическая активность возрастает от
углерода (графит) к германию, а среди
аллотропных модификаций углерода
наименее химически активен алмаз. При
пропускании, водяного пара через сильно
нагретые
).
Химическая активность возрастает от
углерода (графит) к германию, а среди
аллотропных модификаций углерода
наименее химически активен алмаз. При
пропускании, водяного пара через сильно
нагретые
![]() ,
,
![]() или
или
![]() можно наблюдать реакции:
можно наблюдать реакции:
![]()
![]()
В кислороде
при высоких температурах
![]() ,
,
![]() ,
,
![]() сгорают с образованием оксидов
сгорают с образованием оксидов
![]() ,
,
![]() ,
,
![]() и
и
![]() .
.
С водородом
![]() ,
,
![]() ,
,
![]() непосредственно не взаимодействуют, а
с
непосредственно не взаимодействуют, а
с
![]() вступает в реакцию только
вступает в реакцию только
![]() с образованием при t
выше 1300 °С белого вещества состава
тетранитрида трикремния
с образованием при t
выше 1300 °С белого вещества состава
тетранитрида трикремния
![]() .
Кремний, в отличие от
.
Кремний, в отличие от
![]() ,
может взаимодействовать с углеродом
при температуре около
,
может взаимодействовать с углеродом
при температуре около
![]() с образованием карбида кремния
с образованием карбида кремния
![]() -химически инертного вещества, по
твердости уступающего только алмазу.
-химически инертного вещества, по
твердости уступающего только алмазу.
На углерод и кремний азотная, серная, хлорная и галогенводородные кислоты в обычных условиях не действуют.
В
присутствии порошка меди кремний
взаимодействует с безводным
![]() :
:
![]()
Эта реакция используется для промышленного получения трихлорсилана.
Аморфный
углерод
![]() (активированный или древесный уголь)
более химически активен. Азотная кислота
(активированный или древесный уголь)
более химически активен. Азотная кислота
![]() окисляет его до
окисляет его до
![]() :
:
![]()
В
![]() германий подвергается пассивированию,
но при нагревании медленно взаимодействует
по реакции:
германий подвергается пассивированию,
но при нагревании медленно взаимодействует
по реакции:
![]()
Он
взаимодействует с растворами
![]() и
и
![]() :
:
![]()
![]()
Расплавы
и водные растворы
![]() и
и
![]() взаимодействуют только с
взаимодействуют только с
![]() и
и
![]() :
:
![]()
![]()
Углерод
вступает в реакции с галогенами при
нагревании. Со фтором углерод образует
продукты состава
![]() ,
где n
≥ 1 (
,
где n
≥ 1 (![]() ,
,
![]() ,
,
![]() и т.д.), а с другими галогенами «n»
уменьшается до n=4,
например
и т.д.), а с другими галогенами «n»
уменьшается до n=4,
например
![]() ,
,![]() .
.
Известно
несколько оксидов углерода (![]() ,
,
![]() ,
,
![]() )
и по 2 оксида
)
и по 2 оксида
![]() и
и
![]() (
(![]() ,
,
![]() ,
,
![]() ,
,
![]() ).
Восстановительные свойства
).
Восстановительные свойства
![]() при повышенной температуре сильнее,
чем у водорода в реакции:
при повышенной температуре сильнее,
чем у водорода в реакции:
![]()
![]() - восстановитель
- восстановитель
![]() - окислитель
- окислитель
![]() участвует в реакции
присоединения:
участвует в реакции
присоединения:
![]() - формиат калия
- формиат калия
0,5 мПа
С металлами
![]() образует комплексные соединения
карбониды:
образует комплексные соединения
карбониды:
![]()
Для
синтеза
![]() применяют главным образом следующие
реакциии:
применяют главным образом следующие
реакциии:
![]() - в промышленности
- в промышленности
 t
t
в
лаборатории![]()
t
![]()
Д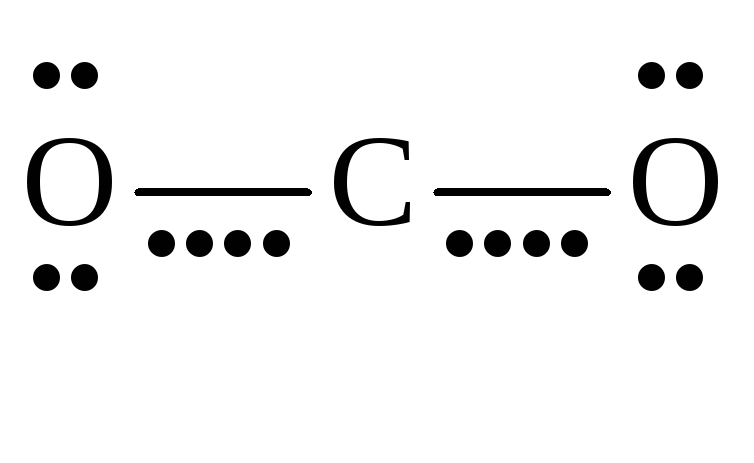 иоксид
углерода -
иоксид
углерода -
![]() - газ без цвета и запаха, тяжелее воздуха.
Твердый
- газ без цвета и запаха, тяжелее воздуха.
Твердый
![]() возгоняется без плавления при 78°C.
В жидком состоянии он может находиться
только под давлением. Молекула
возгоняется без плавления при 78°C.
В жидком состоянии он может находиться
только под давлением. Молекула
![]() линейная, длина связи
линейная, длина связи
![]() -
-
![]() равна 116 пм:
равна 116 пм:
В воде
![]() растворяется: 1 л воды при 25°С и 0,1 мПа
поглощает 0,76 л
растворяется: 1 л воды при 25°С и 0,1 мПа
поглощает 0,76 л
![]() .
Только 1%
.
Только 1%
![]() взаимодействует с водой, образуя угольную
кислоту:
взаимодействует с водой, образуя угольную
кислоту:
![]()
Диоксид
углерода превращает водные растворы
щелочных и щелочноземельных металлов
и магния в гидрокарбонаты при избытке
![]() :
:
![]()
Гидроксиды
и оксиды этих же элементов поглощают
![]() из воздуха:
из воздуха:
![]()
Диоксид
углерода и водорода взаимодействуют
(![]() ,
,
![]() )
в присутствии катализатора (смесь
)
в присутствии катализатора (смесь
![]() и
и
![]() )
с образованием метанола:
)
с образованием метанола:
![]()
![]() получают в промышленности
при разложении известняка:
получают в промышленности
при разложении известняка:
![]()
В лаборатории его получают по реакции:
![]()
В свободном
виде мономерные кислородные кислоты
углерода, кремния и германия (![]() ,
,
![]() ,
,
![]() )
не получены.
)
не получены.
Карбонаты
под действием кислот выделяют
![]() :
:
![]()
Протолиз
![]() в водном растворе протекает в основном
до образования гидрокарбонатных анионов.
в водном растворе протекает в основном
до образования гидрокарбонатных анионов.
![]()
![]()
Анионная
кислота
![]() является еще более слабой:
является еще более слабой:
![]()
![]()
Кремниевые
и германиевые кислоты слабее угольной,
они выпадают в осадок при пропускании
![]() через их водный раствор.
через их водный раствор.