
Раздел I. Термодинамические и молекулярно-кинетические свойства газового состояния
Изучение атомно-молекулярных систем может проводиться с двух различных позиций. Во-первых, система может рассматриваться как целое, и тогда характеристиками являются макропараметры, такие как масса, объем, плотность, температура, давление и т. д. Такой подход получил название термодинамического.
Второй подход основан на описании поведения отдельных элементов системы. Так, всякая атомно-молекулярная система состоит из элементов, каждый из которых имеет свои характеристики, такие, как масса атома, масса молекулы, скорость молекулы, ее импульс, ее полная энергия и т. д. Как же описывать такую систему, число элементов в которой очень велико. В динамике задаются начальные условия (положение и скорость частицы в начальный момент времени), затем на основе законов динамики производится расчет положения частицы в произвольный момент времени. Однако время наблюдения за поведением молекул всегда много больше времени их динамического поведения, а значит необходимо вводить вероятностные характеристики и функции распределения молекул по координатам и скоростям, по которым затем находить средние значения величин, например, скорости, плотности, кинетической энергии. Этот метод изучения поведения атомно-молекулярных систем, основанный на анализе статистических закономерностей и вероятностном описании систем, назван молекулярно-кинетическим.
Очевидно, результат анализа поведения термодинамической системы не должен зависеть от используемого метода. При описании различных явлений термодинамический и молекулярно-кинетический методы часто применяются совместно, подтверждая, дополняя и углубляя выводы друг друга.
Рассмотрим некоторые параметры, характеризующие состояние системы ‑ параметры состояния, которые будут использоваться при термодинамическом описании системы. Одним из параметров состояния является объем. Для газа этот параметр задается внешними условиями, поскольку газ занимает весь предоставленный ему объем, и является для газа внешним параметром.
§ 1. Основное уравнение молекулярно-кинетической теории газов
Газовое состояние вещества характеризуется значениями полной энергии молекул, большими нуля. Как следует из графика зависимости потенциальной энергии взаимодействия молекул, кинетическая энергия молекул газа больше, часто много больше, их потенциальной энергии, так что последней можно пренебречь, а взаимодействие свести к взаимным столкновениям. Именно с этого простейшего структурного состояния (скорее бесструктурного) мы начнем изучение молекулярно-кинетических и термодинамических свойств систем.
Произведем
оценку отношения расстояния между
молекулами газа к размеру его молекул.
Для этого используем экспериментальные
значения плотностей воды и воздуха при
нормальных условиях, равные соответственно
103 кг/м3
и 1,29 кг/м3.
Отношение этих плотностей
![]() составляет 103.
То есть равные массы воды и находящегося
при нормальных условиях воздуха занимают
объемы, отличающиеся в 103
раз. Таково же и отношение объемов,
приходящихся на одну молекулу. Будем
считать, что на каждую молекулу приходится
куб, ребро которого равно расстоянию
между молекулами. Значит расстояние
между молекулами атмосферных газов при
нормальных условиях в 10 раз больше
расстояния между молекулами воды. Однако
известно, что расстояние между молекулами
твердых тел и жидкостей имеет порядок
размера молекул, то есть расстояние
между молекулами газов в атмосфере в
нормальных условиях в 10 раз больше
размеров самих молекул. Проведенная
оценка справедлива для любых газов,
находящихся в привычных земных условиях.
Итак, расстояние между молекулами газа
в широком диапазоне внешних условий
значительно больше размеров молекул.
Из этого факта можно сделать два важных
вывода. Во-первых, в обычных земных
условиях молекулы газа можно считать
материальными точками. Во-вторых, так
как потенциальное взаимодействие между
молекулами газа, находящегося при
нормальных условиях, очень незначительно,
то им можно пренебречь.
составляет 103.
То есть равные массы воды и находящегося
при нормальных условиях воздуха занимают
объемы, отличающиеся в 103
раз. Таково же и отношение объемов,
приходящихся на одну молекулу. Будем
считать, что на каждую молекулу приходится
куб, ребро которого равно расстоянию
между молекулами. Значит расстояние
между молекулами атмосферных газов при
нормальных условиях в 10 раз больше
расстояния между молекулами воды. Однако
известно, что расстояние между молекулами
твердых тел и жидкостей имеет порядок
размера молекул, то есть расстояние
между молекулами газов в атмосфере в
нормальных условиях в 10 раз больше
размеров самих молекул. Проведенная
оценка справедлива для любых газов,
находящихся в привычных земных условиях.
Итак, расстояние между молекулами газа
в широком диапазоне внешних условий
значительно больше размеров молекул.
Из этого факта можно сделать два важных
вывода. Во-первых, в обычных земных
условиях молекулы газа можно считать
материальными точками. Во-вторых, так
как потенциальное взаимодействие между
молекулами газа, находящегося при
нормальных условиях, очень незначительно,
то им можно пренебречь.
Эти выводы являются обоснованием модели идеального газа, которая состоит в следующем:
-
Молекулы газа ‑ материальные точки с массой m0.
-
Взаимодействие молекул газа между собой и со стенками сосуда осуществляется только путем упругих соударений.
Сразу можно отметить внутреннюю противоречивость данной модели: столкновения между материальными точками невозможны, поэтому модель нуждается в дополнении. При количественном описании столкновений, молекулы газа рассматриваются как шарики с радиусом около 10-10 м.
Применим эту модель для установления связи между макроскопическим параметром газа - давлением и микроскопическими параметрами, характеризующими молекулы газа. Качественная молекулярно-кинетическая модель давления проста. Из курса механики известно, что давление численно равно нормальной составляющей силы, действующей на единицу площади границы раздела поверхностей:
![]() . (1.1)
. (1.1)
Каждая молекула газа при столкновении со стенкой передает ей импульс, т.е., согласно второму закону Ньютона, действует на стенку с некоторой, пусть и очень малой, силой. Действия отдельных молекул суммируются в одну силу, создающую давление на поверхность.
Определим давление, оказываемое газом на стенку сосуда. Пусть газ, к которому применима модель идеального газа, находится в сферическом сосуде радиуса R. В результате столкновений молекул между собой и со стенками сосуда изменяются величины и направления их скоростей. За конечное время в сосуде установится распределение скоростей молекул, не зависящее от области в сосуде и от времени. Таким образом, импульс, передаваемый единице поверхности стенки сосуда за единицу времени, не будет меняться с течением времени, т.е. давление идеального газа на стенки сосуда не зависит от того, как и какие молекулы сталкиваются, как именно меняется скорость отдельной молекулы, и система находится в состоянии термодинамического равновесия. В этом случае в неизменных внешних условиях распределение молекул по скоростям не изменяется, следовательно, давление на стенки сосуда не зависит от столкновений молекул между собой и можно считать, что молекулы сталкиваются только со стенками. Очевидно, в данной ситуации молекулы газа, действительно могут рассматриваться как материальные точки.
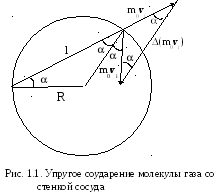
Рассмотрим удар i-ой молекулы о стенку сосуда (рис. 1.1). По второму закону Ньютона
![]() (1.2)
(1.2)
где
![]() -
сила, действующая на i-ую молекулу со
стороны стенки,
-
сила, действующая на i-ую молекулу со
стороны стенки,
![]() ‑
время удара молекулы о стенку,
‑
время удара молекулы о стенку,
![]() ‑
скорость i-ой частицы, m0
- масса молекулы. Из рис. 1.1 видно, что
модуль импульса силы
‑
скорость i-ой частицы, m0
- масса молекулы. Из рис. 1.1 видно, что
модуль импульса силы
![]() равен удвоенному произведению модуля
импульса частицы
равен удвоенному произведению модуля
импульса частицы
![]() на косинус угла a
падения частицы на стенку:
на косинус угла a
падения частицы на стенку:
![]() . (1.3)
. (1.3)
По
третьему закону Ньютона такая же по
модулю сила действует и на стенку.
Действие частицы на стенку можно
усреднить по времени, считая, что частица
действует на стенку не только в момент
удара, но и на всем промежутке времени
![]() между двумя последовательными
столкновениями с некоторой средней по
времени силой, такой чтобы модуль
импульса силы остался неизменным.
между двумя последовательными
столкновениями с некоторой средней по
времени силой, такой чтобы модуль
импульса силы остался неизменным.
![]() . (1.4)
. (1.4)
Так
как в принятой модели в состоянии
термодинамического равновесия можно
не учитывать столкновения между
молекулами, движение молекулы между
двумя последовательными соударениями
со стенкой является равномерным и
![]() ,
где
,
где
![]() ‑
расстояние, которое молекула проходит
между двумя последовательными
столкновениями со стенкой сосуда, значит
‑
расстояние, которое молекула проходит
между двумя последовательными
столкновениями со стенкой сосуда, значит
![]() . (1.5)
. (1.5)
Тогда выражение для средней силы можно с учетом (1.5) записать в виде:
![]() . (1.6)
. (1.6)
Выражение
(1.6)
стоить обсудить особо. Правая часть
этого соотношения совпадает с выражением
для центростремительной силы. Таким
образом, попутно получен интересный
результат: в среднем молекула движется
по окружности. Что вовсе не случайно,
так как движение частицы ограничено
сферическим сосудом. Из (1.6) следует так
же, что
![]() не зависит от параметров удара, значит,
молекула действует на стенку с одинаковой
средней силой в течение каждого промежутка
времени между столкновениями.
не зависит от параметров удара, значит,
молекула действует на стенку с одинаковой
средней силой в течение каждого промежутка
времени между столкновениями.
Давление газа на стенку сосуда определяется суммой средних нормальных составляющих сил, действующих на стенку со стороны всех молекул в сосуде:
![]() , (1.7)
, (1.7)
где
S - площадь поверхности “обстукиваемой”
молекулами, которая равна
![]() .
Так как удары считаются абсолютно
упругими, угол падения частицы на
поверхность равен углу отражения. Это
приводит к тому, что силы, с которыми
действуют на стенку частицы, во время
каждого удара направлены перпендикулярно
поверхности стенки (см. рис. 1.1), то
есть касательная составляющая равна
нулю. Тогда выражение для давления (1.7)
с учетом последних замечаний и соотношения
(1.6) примет вид
.
Так как удары считаются абсолютно
упругими, угол падения частицы на
поверхность равен углу отражения. Это
приводит к тому, что силы, с которыми
действуют на стенку частицы, во время
каждого удара направлены перпендикулярно
поверхности стенки (см. рис. 1.1), то
есть касательная составляющая равна
нулю. Тогда выражение для давления (1.7)
с учетом последних замечаний и соотношения
(1.6) примет вид
![]() . (1.8)
. (1.8)
Умножим
числитель и знаменатель правой части
выражения (1.8) на число молекул в сосуде
N, учтем, что
![]() есть объем сосуда V и получим
есть объем сосуда V и получим
![]() . (1.9)
. (1.9)
Сумма
квадратов скоростей частиц, деленная
на число частиц, дает средний квадрат
скорости
![]() ,
отношение числа частиц к объему ‑
среднюю концентрацию
,
отношение числа частиц к объему ‑
среднюю концентрацию
![]() молекул в сосуде. Итак, окончательно
получаем
молекул в сосуде. Итак, окончательно
получаем
![]() (1.
10)
(1.
10)
или иначе, с использованием средней кинетической энергии
![]() , (1.11)
, (1.11)
![]() (1.12)
(1.12)
Принято среднюю концентрацию записывать без знака усреднения:
![]() (1.13)
(1.13)
Выражение (1.13) носит название основного уравнения молекулярно-кинетической теории газов. Итак, давление идеального газа - макроскопический параметр - определяется микроскопическими параметрами: средней концентрацией и средней кинетической энергией молекул.
Основное уравнение МКТ газов справедливо в модели идеального газа, когда газ находится в состоянии термодинамического равновесия. Это условие явно использовано при выводе этого уравнения. Основное уравнение МКТ позволяет расширить наши представления о признаках равновесного состояния.
