
§ 5. Параметры критического состояния реального газа. Закон соответственных состояний
Вернемся к анализу изотерм реального газа. Выше показано, что при «низких» температурах и больших объемах газа можно пренебречь вторым слагаемым в (7.3.2). При повышении температуры изотермического сжатия, это условие выполняется для всё большего диапазона объемов. Аналогично, расширяется область малых значений объема, для которых при низких температурах можно пренебречь первым слагаемым в (7.3.2). Таким образом, границы S-образного участка уменьшаются и при некоторой температуре, называемой критической температурой, он вырождается в точку перегиба, в которой равны нулю первая и вторая производные давления по объему:
![]() . (7.5.1)
. (7.5.1)
Теперь понятен
критерий деления температур на высокие
и низкие. Температуры большие критической
рассматривались нами как высокие, а
меньшие критической - как низкие. В §1
данного раздела приведены экспериментальные
значения критической температуры
![]() .
.
Поставим теперь
задачу вычисления в модели газа
Ван-дер-Ваальса значений критической
температуры, объема
![]() и давления
и давления
![]() реального газа в критическом состоянии.
Указанные значения можно получить из
условия (7.5.1), но можно воспользоваться
более простым способом. В критической
точке все три корня кубического уравнения
равны, поэтому в критической точке
выполняется соотношение
реального газа в критическом состоянии.
Указанные значения можно получить из
условия (7.5.1), но можно воспользоваться
более простым способом. В критической
точке все три корня кубического уравнения
равны, поэтому в критической точке
выполняется соотношение
![]() . (7.5.2)
. (7.5.2)
С другой стороны, уравнение Ван-дер-Ваальса для критического состояния, согласно (7.3.1), запишется в виде:
![]() . (7.5.3)
. (7.5.3)
Раскладывая куб в выражении (7.5.2) и приравнивая коэффициенты при соответствующих степенях объема, получаем систему трех уравнений
 . (7.5.4)
. (7.5.4)
Решением системы уравнений являются значения критических параметров реального газа:
![]() , (7.5.5)
, (7.5.5)
![]() , (7.5.6)
, (7.5.6)
![]() . (7.5.7)
. (7.5.7)
Уравнение
Ван-дер-Ваальса в форме (7.2.5) содержит
характеристики газа
![]() и
и
![]() .
Можно ли получить уравнение реального
газа в виде, одинаковом для всех газов,
к которым можно применить модель
реального газа? Введем новые переменные
.
Можно ли получить уравнение реального
газа в виде, одинаковом для всех газов,
к которым можно применить модель
реального газа? Введем новые переменные
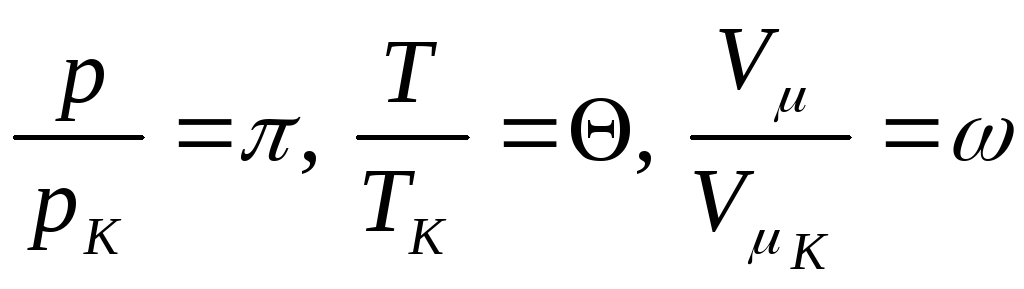 . (7.5.8)
. (7.5.8)
Воспользуемся соотношениями (7.5.5), (7.5.6), (7.5.7), тогда
![]() . (7.5.9)
. (7.5.9)
Произведя в уравнении Ван-дер-Ваальса (7.2.5) замену переменных (7.5.9), после алгебраических преобразований получим
![]() . (7.5.10)
. (7.5.10)
Уравнение Ван-дер-Ваальса в форме (7.5.10) получило название закона соответственных состояний. В это уравнение не входят характеристики конкретного газа, что имеет очень важные теоретические и практические следствия. Закон соответственных состояний говорит о том, что существуют общие закономерности перехода из газообразного состояния в жидкое. Поэтому появилась уверенность в возможности сжижения таких атмосферных газов как азот, водород, кислород. В дальнейшем жидкие азот, водород и кислород были получены и используются в различных областях науки и техники.
Итак, модель
Ван-дер-Ваальса привела к получению
важных теоретических выводов и
практических результатов. Она позволила
описать поведение газов в более широком
диапазоне параметров. Как и всякая
модель, она имеет свои границы применимости.
Ею можно пользоваться пока поправка на
дополнительное давление, связанная с
учетом притяжения между молекулами,
много меньше внешнего давления
![]() ,
а поправка на собственный объем много
меньше объема газа
,
а поправка на собственный объем много
меньше объема газа
![]() .
Кроме того, количественно модель хорошо
описывает поведение легких газов, а
тяжелых - плохо. Ценность модели
заключается и в том, что в ней предсказывается
существование метастабильных состояний.
.
Кроме того, количественно модель хорошо
описывает поведение легких газов, а
тяжелых - плохо. Ценность модели
заключается и в том, что в ней предсказывается
существование метастабильных состояний.
