
§ 7. Внутренняя энергия реального газа. Эффект Джоуля-Томсона.
В отличие от
идеального газа, внутренняя энергия
которого складывается только из
кинетических энергий молекул, внутренняя
энергия реального газа представляет
собой сумму кинетической энергии и
потенциальной энергии взаимодействия
молекул. Вклад кинетической энергии
равен суммарной кинетической энергии
идеального газа
![]() .
При расширении производится работа
против сил взаимодействия молекул. Ее
можно определить как
.
При расширении производится работа
против сил взаимодействия молекул. Ее
можно определить как
![]() .
С учетом выражения для поправки на
внутреннее давление
.
С учетом выражения для поправки на
внутреннее давление
![]() ,
приращение внутренней энергии реального
газа запишется в виде:
,
приращение внутренней энергии реального
газа запишется в виде:
![]() . (7.7.1)
. (7.7.1)
Выражение для внутренней энергии реального газа получим, проинтегрировав последнее выражение:
![]() . (7.7.2)
. (7.7.2)
Постоянная интегрирования принята равной нулю. Первое слагаемое в (7.7.2) определяет вклад кинетической энергии, связанной с хаотическим движением, а второе - вклад, связанный с взаимодействие молекул.
Рассмотрим процесс
адиабатного расширения реального газа
в пустоту. В силу адиабатности процесса
теплота газу не передается
![]() ,
так как расширяется газ в пустоту,
давление рано нулю и, следовательно,
работа не совершается
,
так как расширяется газ в пустоту,
давление рано нулю и, следовательно,
работа не совершается
![]() .
Согласно первому началу термодинамики,
внутренняя энергия газа при этом не
изменяется и
.
Согласно первому началу термодинамики,
внутренняя энергия газа при этом не
изменяется и
![]() .
Тогда из (7.7.1) следует, что
.
Тогда из (7.7.1) следует, что
![]() , (7.7.3)
а
следовательно
, (7.7.3)
а
следовательно
![]() , (7.7.4)
т.е.
температура в общем случае должна
изменяться.
, (7.7.4)
т.е.
температура в общем случае должна
изменяться.
С учетом
![]() выражение (7.7.2) можно записать в виде
выражение (7.7.2) можно записать в виде
![]() . (7.7.5)
. (7.7.5)
Поскольку при расширении газа в пустоту его объем возрастает, то второе слагаемое (7.7.5) уменьшается по величине, а следовательно, и значение первого слагаемого должно уменьшиться. Это возможно только при понижении температуры газа.
Д ля
получения низких температур Джоуль и
Томсон предложили использовать сосуд
с обеих сторон герметично закрытый
поршнями и разделенный теплоизолированной
пористой перегородкой (рис.7.7.1).
ля
получения низких температур Джоуль и
Томсон предложили использовать сосуд
с обеих сторон герметично закрытый
поршнями и разделенный теплоизолированной
пористой перегородкой (рис.7.7.1).
С обеих сторон от перегородки находится газ при условиях, в которых средняя длина свободного пробега молекул больше размеров пор (таким образом в пористой перегородке молекулы газа находятся в условиях вакуума). Давления справа и слева от перегородки различны, но не изменяются, поддерживаются постоянными с помощью поршней.
Газ продавливается через перегородку (прохождение газа через пористую перегородку называется дросселированием). Так как перегородка представляет собой гидродинамическое сопротивление для течения газа, то над газом совершается работа, а после дросселирования (справа от перегородки) давление газа уменьшается. Так как процесс идет адиабатно, то из первого начала термодинамики следует, что приращение внутренней энергии газа равно работе, совершенной над газом. Когда эта работа отрицательна, внутренняя энергия газа уменьшается, что говорит об уменьшении его температуры, в противном случае - температура повышается. Этот эффект, наблюдающийся при дросселировании газа получил название - эффект Джоуля-Томсона.
Изменение температуры реального газа при малом изменении его плотности в адиабатических условиях (7.7.4) называется дифференциальным эффектом Джоуля-Томсона. Дифференциальный эффект Джоуля-Томсона наблюдается при бесконечно малом изменении объема, и, следовательно, бесконечно малом изменении давления выделенной порции газа. Такой процесс, в отличие от интегрального эффекта является равновесным. Реализовать такой процесс можно при перетекании газа через пористую перегородку.
П усть
в начальном состоянии некоторая масса
газа, находясь в левой части сосуда,
занимала объем
усть
в начальном состоянии некоторая масса
газа, находясь в левой части сосуда,
занимала объем
![]() ,
после перетекания через перегородку
ее объем увеличился до
,
после перетекания через перегородку
ее объем увеличился до
![]() (рис. 7.7.2).
(рис. 7.7.2).
При сжатии газа
от первоначального объема до нуля (газ
полностью перетекает в правую часть
сосуда) над газом производится работа
![]() .
Расширяясь, газ совершает работу
.
Расширяясь, газ совершает работу
![]() .
Тогда полная работа, совершенная газом,
с учетом знаков, определяется соотношением:
.
Тогда полная работа, совершенная газом,
с учетом знаков, определяется соотношением:
![]() . (7.7.6)
. (7.7.6)
Так как система теплоизолирована, первое начало термодинамики примет вид:
![]() (7.7.7)
(7.7.7)
или
![]() . (7.7.8)
. (7.7.8)
Термодинамическая
функция
![]() ,
называется энтальпией. Таким образом,
процесс Джоуля-Томсона является
изоэнтальпийным
процессом
,
называется энтальпией. Таким образом,
процесс Джоуля-Томсона является
изоэнтальпийным
процессом
![]() . (7.7.9)
. (7.7.9)
До этого момента рассуждения проводились без учета уравнения состояния, описывающего поведение газа. Единственным накладываемым ограничением являлась стационарность процесса протекания газа через перегородку, так как разность давлений считалась установившейся (постоянной).
Теперь будем считать, что в первоначальном состоянии 1 моль газа находился в условиях, когда применима модель реального газа, то есть уравнением состояния служит уравнение Ван-дер-Ваальса. Тогда, считая теплоемкость не зависящей от температуры, из (7.7.5) получаем
![]() . (7.7.10)
. (7.7.10)
Согласно уравнению Ван-дер-Ваальса в форме (7.3.2)
![]() , (7.7.11)
, (7.7.11)
и энтальпия газа в начальном состоянии определяется соотношением
![]() . (7.7.12)
. (7.7.12)
После расширения
газ займет объем
![]() .
Конечное состояние газа можно принять
настолько разреженным, что его поведение
моделируется уравнением Менделеева-Клапейрона
для идеального газа. Следовательно,
энтальпия газа в конечном состоянии
равна
.
Конечное состояние газа можно принять
настолько разреженным, что его поведение
моделируется уравнением Менделеева-Клапейрона
для идеального газа. Следовательно,
энтальпия газа в конечном состоянии
равна
![]() . (7.7.13)
. (7.7.13)
На основе выражений (7.7.12) и (7.7.13) после алгебраических преобразований условие изоэнтальпийности процесса (7.7.9) запишется в виде
![]() , (7.7.14)
, (7.7.14)
где учтено уравнение
Майера
![]() .
.
Изменения температуры в процессе дросселирования не происходит тогда, когда правая часть выражения (7.7.14) равна нулю. Это возможно в двух случаях.
Во-первых, когда
коэффициенты
![]() и
и
![]() одновременно равны нулю, что справедливо
в случае идеального газа. Для идеального
газа эффект Джоуля-Томсона не наблюдается.
Этот вывод можно получить и непосредственно
из условия (7.7.9), приняв в качестве
уравнения состояния и в начальном, и в
конечном состоянии уравнение
Менделеева-Клапейрона.
одновременно равны нулю, что справедливо
в случае идеального газа. Для идеального
газа эффект Джоуля-Томсона не наблюдается.
Этот вывод можно получить и непосредственно
из условия (7.7.9), приняв в качестве
уравнения состояния и в начальном, и в
конечном состоянии уравнение
Менделеева-Клапейрона.
Во-вторых, изменения температуры не происходит, когда
![]() , (7.7.15)
, (7.7.15)
то есть когда
![]()
 .
(7.7.16)
.
(7.7.16)
Температура,
определяющаяся выражением (7.7.16) называется
температурой
инверсии.
Она получила такое название, поскольку
разделяет температурное поле на две
области. При начальных температурах,
больших температуры инверсии, температура
газа увеличивается (см. 7.7.12), и эффект
считается отрицательным. Если
![]() наблюдается положительный эффект, то
есть охлаждение газа.
наблюдается положительный эффект, то
есть охлаждение газа.
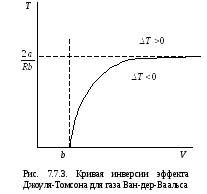
Кривая инверсии
эффекта Джоуля -Томсона - зависимость
температуры инверсии от начального
объема - для газа Ван-дер-Ваальса
изображена на рис.7.7.3. Точки этой кривой
определяют значения
![]() и
и
![]() ,
при которых
,
при которых
![]() .
Точки, лежащие выше кривой, определяют
значения
.
Точки, лежащие выше кривой, определяют
значения
![]() и
и
![]() ,
при которых
,
при которых
![]() ,
т.е. эффект отрицательный. Точки, лежащие
ниже кривой, определяют значения
,
т.е. эффект отрицательный. Точки, лежащие
ниже кривой, определяют значения
![]() и
и
![]() ,
при которых эффект положителен (
,
при которых эффект положителен (![]() ).
).
Таким образом,
знак и величина эффекта определяются
начальной температурой и начальным
объемом (или начальным давлением). При
![]() эффект будет всегда отрицательным. При
эффект будет всегда отрицательным. При
![]() эффект будет положительным только при
достаточно большом начальном объеме,
т.е. при достаточно малом начальном
давлении.
эффект будет положительным только при
достаточно большом начальном объеме,
т.е. при достаточно малом начальном
давлении.
Подчеркнем, что эффект Джоуля-Томсона всецело обусловлен отклонениями газа от идеальности. Рассмотренный выше эффект наблюдается, когда разность давлений имеет конечное значение и потому называется интегральным эффектом Джоуля-Томсона.
