
- •1.Предмет и задачи химии. Понятие о материи и вещ-ве. Место химии среди естест-ных наук
- •2.Основные понятия в химии: относительная атомная масса химического элемента, отно-сительная молекулярная масса вещества, моль, молярная масса, молярный объем.
- •3. Простые и сложные вещества. Степень окисления атома элемента в соединении. Состав-ление формул бинарных соединений по известным степеням окисления.
- •4. Оксиды: определение, классификация, номенклатура, методы получения, важнейшие химические свойства.
- •Основания: определение, классификация, номенклатура, диссоциация, важнейшие химические свойства. Методы получения.
- •5. Кислоты: определение, классификация, номенклатура, диссоциация, важнейшие хими-ческие свойства. Методы получения.
- •7. Соли: определение, классификация, номенклатура. Диссоциация. Важнейшие свойства. Методы получения кислых, средних (нормальных) и основных солей.
- •10. Элементарные частицы – протоны, нейтроны и электроны.
- •11. Атомные ядра, их строение. Заряд атома. Массовое число. Понятие о химическом эле-менте. Изотопы. Относительная атомная масса химического элемента.
- •14. Периодический закон д.И. Менделеева. Структура периодической системы.
- •15. Связь электронных структур атомов с их положением в периодической системе. Причины периодичности. Валентные электроны для атомов s-, p-, d- и f-элементов.
- •17. Типы химической связи. Ковалентная связь. Метод валентных связей (вс). Механизм образования ковалентной связи (обменный и донорно-акцепторный). Свойства ковалентной связи.
- •18. Ионная связь как предельный случай ковалентной полярной связи, ее особенности.
- •Водородная связь, ее особенности.
- •Виды межмолекулярного взаимодействия.
- •21. Термодинамические системы и их классификация.
- •22. Тепловой эффект химической реакции. Экзо- и эндо-термические реакции. Внутренняя энергия и энтальпия. Их связь с тепловым эффектом реакции.
- •23. Первый закон термодинамики. Закон Гесса. Условия его применения. Теплоты и энталь-пии образования химических соединений. Следствия из закона Гесса.
- •24. Особенности термохимических уравнений. Методы определения тепловых эффектов химических реакций.
- •25. Энтропия как мера вероятности состояния системы. Факторы, определяющие величину энтропии системы. Методы определения энтропии физико-химических процессов. Второй закон термодинамики.
- •29. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Активные молекулы. Энергия активации. Уравнение Аррениуса.
- •Катализ и катализаторы. Гомогенный и гетерогенный катализ.
- •31. Химическое равновесие. Константа равновесия для гомогенных и гетерогенных систем, факторы, от которых она зависит.
- •32. Смещение химического равновесия. Принцип Ле-Шателье.
- •33. Основные положения теории электролитической диссоциации. Степень диссоциации. Сильные и слабые электролиты. Константа диссоциации слабых электролитов. Закон разбавления Оствальда.
- •34. Диссоциация малорастворимых веществ. Произведение растворимости.
- •35. Диссоциация воды. Ионное произведение воды. Водородный показатель (рН).
- •36. Реакции обмена в растворах электролитов. Обратимые и необратимые реакции. Условия смещения равновесия в обратимых реакциях.
- •37. Гидролиз солей. Константа и степень гидролиза. Факторы, влияющие на степень гидролиза.
- •38. Окислительно-восстановительные реакции. Важнейшие окислители и восстановители. Классификация окислительно-восстановительных реакций.
- •39. Методы подбора коэффициентов в окислительно-восстановительных реакциях: метод электронного баланса, ионно-электронный метод. Роль среды в окислительно-восстановительных реакциях.
- •Гальванический элемент. Его устройство и принцип действия. (картинка!)
- •41. Эдс гальванического элемента, ее связь с ∆g процесса. Электродный потенциал, механизм его возникновения, факторы, влияющие на величину электродного потенциала.
- •42. Типы электродов: металлические, газовые, окислительно-восстановительные. Стандартный водородный электрод.
- •43. Методы измерения электродных потенциалов. Стандартные электродные потенциалы. Ряд напряжений. Уравнение Нернста.
- •44. Применение электродных потенциалов для определения возможности протекания окислительно-восстановительных реакций в растворе. ( нет?)
- •45. Понятие об амфотерности. Амфотерные элементы, их оксиды и гидроксиды. Взаимодействие амфотерных элементов и их соединений с кислотами щелочами. (дописать)!
- •46. Коррозия металлов. Виды коррозии. Химическая и электрохимическая коррозии.
42. Типы электродов: металлические, газовые, окислительно-восстановительные. Стандартный водородный электрод.
Металлический электрод 1ого рода представляет собой металлы, погруженные в р-р собственных солей. Обозначение : Меn+/Ме. В случае метал электрода 1ого рода вещ-во, из которого изготовлен электрод химически изменяется (Учувствует в процессах окисления и восстановления).
Металлические э-ды 2ого рода. Представляют собой металлы, покрытиые слоем их труднорастворимого соединения ( соль, оксид, гидроксид, основание) и помещённые в р-ры, содержащие анионы , похожие на анионы их труднорастворимого в-ва. Обозначение : Ann-/MeAn, Me. (н-р хлорсеребреный электрод Cl-/AgCl,Ag).
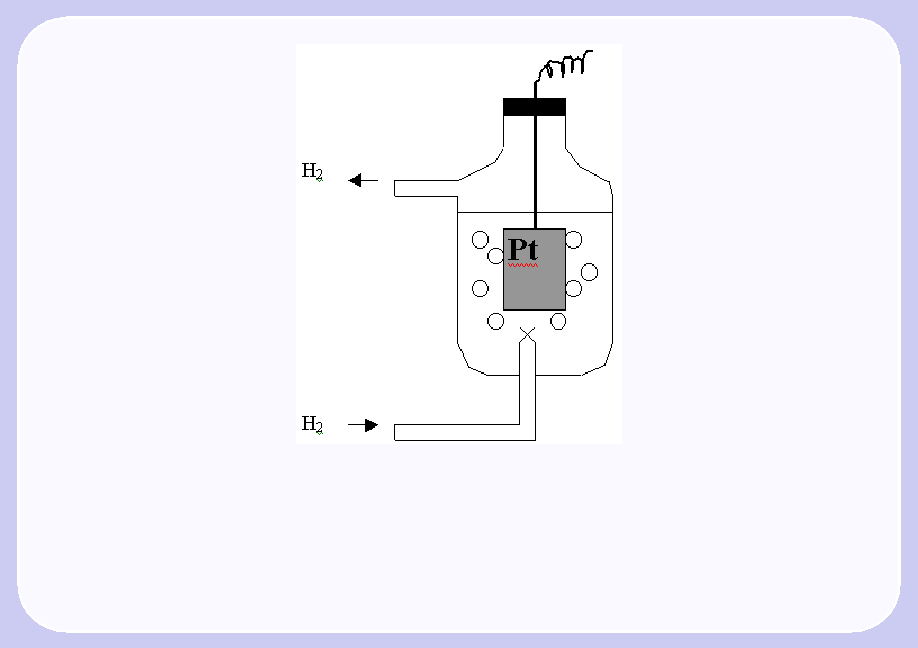
Газовые электроды. (водородный, хлорный, кислородный) Состоят из металлического электрода, контактирующего одновременно с газом и с р-ром, содержащим ионы данного газа. Металлический э-д служит для подвода и отвода электронов, а его собственные ионы в р-р не переходят. (платина, золото, графит,платиновые металлы чаще служат в роли инертных).
Водородный э-д: H2 +mH2O = 2H+ * mH2O + 2e
 H2
– 2e
= 2H+
H2
– 2e
= 2H+
Водородный электрод представляет собой платиновую пластинку, опущенную в водный р-р серной к-ты. Через р-р к-ты пропускают водород под атмосферным давлением. При контакте платины с молекулярным водородом происходит адсорбция водорода на платине. Часть адсорбированного водорода переходит в атомарное состояние. Атомарный водород, взаимодействуя с молекулами воды, переходит в р-р в виде ионов, оставляя на платине электроны. Поверхность платины заряжается отрицательно, а р-р положительно. Возможен и обратный процесс – восстановление ионов водорода с образованием молекулярного водорода.
Абсолютное значение
потенциала водородного электрода не
известно, но условно его принимают = 0.
Потенциал зависит от концентрации ионов
водорода в р-ре и от давления газообразного
водорода. ( кислая среда рН=0,
![]() 2H+/H2
=0 (при
Р=101,3 к Па), нейтр среда: рН=7 фи … = -1414 В;
щелочная среда рН=14 фи …= -0828В)
2H+/H2
=0 (при
Р=101,3 к Па), нейтр среда: рН=7 фи … = -1414 В;
щелочная среда рН=14 фи …= -0828В)
Окислительно-востановительный электод. Представляет собой инертный электрод, опущенный р-р электролита, содержащую окисленную и восстановленную форму в-ва. ( н-р Fe3+, Fe2+/Pt Fe2+ (восстанов форма)- 1e = F3+(окисленная форма)
43. Методы измерения электродных потенциалов. Стандартные электродные потенциалы. Ряд напряжений. Уравнение Нернста.
Абсолютную величину электродного потенциала измерить невозможно. Измеряют относительный электродный потенциал – это разность потенциалов(ЭДС) м-у данным электродом и неким стандартным электродом, потенциал которого условно принят за 0.
Относительный
электродный потенциал зависит от природы
электрода, от Т, от концентрации ионов,
участвующих в электродном процессе.
Зависимость электродного пот-а от этих
факторов выражает ур-е Нэрнста:
![]() ,
,
![]() -
стандартный электродный потенциал –
это потенциал электрода, если активности
окисленной и восстановленной формы =
1моль/ л. (из таблицы), R
– универсальная газовая постоянная(8,31
Дж/моль*К, Т- температура в К, F-
постоянная Фарадея (965000 К/моль), n
– число, необходимых для перехода из
окисленной формы в восстановленную.
-
стандартный электродный потенциал –
это потенциал электрода, если активности
окисленной и восстановленной формы =
1моль/ л. (из таблицы), R
– универсальная газовая постоянная(8,31
Дж/моль*К, Т- температура в К, F-
постоянная Фарадея (965000 К/моль), n
– число, необходимых для перехода из
окисленной формы в восстановленную.
При стандартных
условиях
![]()
Потенциал металл
э-да 1ого рода:Me(вф)-ne=Men+(оф)(![]() )
)
Потенциал водородного
электрода: H2(вф)-2е=2H+(оф)
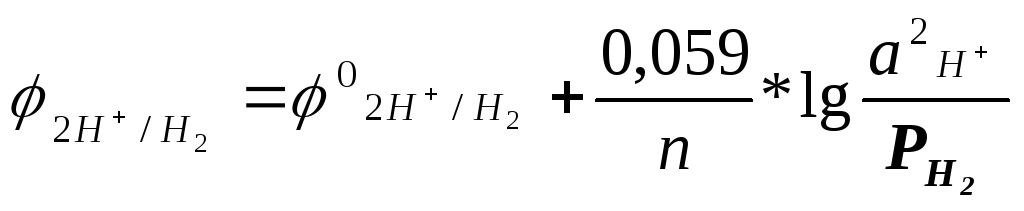 ),
Р- давление и при н. у = 1 атмосфере)
),
Р- давление и при н. у = 1 атмосфере)
Потенциал
окислит-восстановит э-да: Fe3+,
Fe2+/Pt
; Fe2+(в.ф)
– e
= Fe3+(о.ф)
(![]() )
)
Активность воды и тв в-в не учитывается в формулах. рН= -lg[H+] –для задач
Ряд напряжения(активности ) металлов:
Металлы здесь располагаются в порядке возрастания стандартных электродных потенциалов. Ряд активности металлов характеризует ОВ св-ва самих металлов и их ионов. Чем больше (-) значение имеет потенциал металла, тем более сильной восстановительной способностью он обладает. Чем более (+) потенциал металлич э-да, тем более сильной окислительной способностью обладают его ионы. Условие самопроизвольного протекания ОВР в водном р-ре – потенциал ок-ля>потенциала вос-ля.
