
- •1.Предмет и задачи химии. Понятие о материи и вещ-ве. Место химии среди естест-ных наук
- •2.Основные понятия в химии: относительная атомная масса химического элемента, отно-сительная молекулярная масса вещества, моль, молярная масса, молярный объем.
- •3. Простые и сложные вещества. Степень окисления атома элемента в соединении. Состав-ление формул бинарных соединений по известным степеням окисления.
- •4. Оксиды: определение, классификация, номенклатура, методы получения, важнейшие химические свойства.
- •Основания: определение, классификация, номенклатура, диссоциация, важнейшие химические свойства. Методы получения.
- •5. Кислоты: определение, классификация, номенклатура, диссоциация, важнейшие хими-ческие свойства. Методы получения.
- •7. Соли: определение, классификация, номенклатура. Диссоциация. Важнейшие свойства. Методы получения кислых, средних (нормальных) и основных солей.
- •10. Элементарные частицы – протоны, нейтроны и электроны.
- •11. Атомные ядра, их строение. Заряд атома. Массовое число. Понятие о химическом эле-менте. Изотопы. Относительная атомная масса химического элемента.
- •14. Периодический закон д.И. Менделеева. Структура периодической системы.
- •15. Связь электронных структур атомов с их положением в периодической системе. Причины периодичности. Валентные электроны для атомов s-, p-, d- и f-элементов.
- •17. Типы химической связи. Ковалентная связь. Метод валентных связей (вс). Механизм образования ковалентной связи (обменный и донорно-акцепторный). Свойства ковалентной связи.
- •18. Ионная связь как предельный случай ковалентной полярной связи, ее особенности.
- •Водородная связь, ее особенности.
- •Виды межмолекулярного взаимодействия.
- •21. Термодинамические системы и их классификация.
- •22. Тепловой эффект химической реакции. Экзо- и эндо-термические реакции. Внутренняя энергия и энтальпия. Их связь с тепловым эффектом реакции.
- •23. Первый закон термодинамики. Закон Гесса. Условия его применения. Теплоты и энталь-пии образования химических соединений. Следствия из закона Гесса.
- •24. Особенности термохимических уравнений. Методы определения тепловых эффектов химических реакций.
- •25. Энтропия как мера вероятности состояния системы. Факторы, определяющие величину энтропии системы. Методы определения энтропии физико-химических процессов. Второй закон термодинамики.
- •29. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Активные молекулы. Энергия активации. Уравнение Аррениуса.
- •Катализ и катализаторы. Гомогенный и гетерогенный катализ.
- •31. Химическое равновесие. Константа равновесия для гомогенных и гетерогенных систем, факторы, от которых она зависит.
- •32. Смещение химического равновесия. Принцип Ле-Шателье.
- •33. Основные положения теории электролитической диссоциации. Степень диссоциации. Сильные и слабые электролиты. Константа диссоциации слабых электролитов. Закон разбавления Оствальда.
- •34. Диссоциация малорастворимых веществ. Произведение растворимости.
- •35. Диссоциация воды. Ионное произведение воды. Водородный показатель (рН).
- •36. Реакции обмена в растворах электролитов. Обратимые и необратимые реакции. Условия смещения равновесия в обратимых реакциях.
- •37. Гидролиз солей. Константа и степень гидролиза. Факторы, влияющие на степень гидролиза.
- •38. Окислительно-восстановительные реакции. Важнейшие окислители и восстановители. Классификация окислительно-восстановительных реакций.
- •39. Методы подбора коэффициентов в окислительно-восстановительных реакциях: метод электронного баланса, ионно-электронный метод. Роль среды в окислительно-восстановительных реакциях.
- •Гальванический элемент. Его устройство и принцип действия. (картинка!)
- •41. Эдс гальванического элемента, ее связь с ∆g процесса. Электродный потенциал, механизм его возникновения, факторы, влияющие на величину электродного потенциала.
- •42. Типы электродов: металлические, газовые, окислительно-восстановительные. Стандартный водородный электрод.
- •43. Методы измерения электродных потенциалов. Стандартные электродные потенциалы. Ряд напряжений. Уравнение Нернста.
- •44. Применение электродных потенциалов для определения возможности протекания окислительно-восстановительных реакций в растворе. ( нет?)
- •45. Понятие об амфотерности. Амфотерные элементы, их оксиды и гидроксиды. Взаимодействие амфотерных элементов и их соединений с кислотами щелочами. (дописать)!
- •46. Коррозия металлов. Виды коррозии. Химическая и электрохимическая коррозии.
17. Типы химической связи. Ковалентная связь. Метод валентных связей (вс). Механизм образования ковалентной связи (обменный и донорно-акцепторный). Свойства ковалентной связи.
Химическая связь – связь между атомами в молекулах кристаллов и сложных ионов. Причины образования хим. связей – выделение энергии.
Различают следующие типы хим. связей: ионная, ковалентная, металлическая.
Ионная – образуется за счёт электростатического притяжения противоположно заряженных ионов. Ионы образуются за счёт отдачи или принятия электронов.
Ковалентная связь
образуется за счёт общих электронных
пар. Различают ковалентную неполярную
и полярную связи. Критерием оценки типа
связи служит дельта относительной
электроотрицательности (![]() ОЭО).
Если
ОЭО).
Если
![]() ОЭО=0,
то связь ков. неп., если
ОЭО=0,
то связь ков. неп., если
![]() ОЭО>0
– ков. пол.(общая электронная пара
смещается к более электроотрицательному
атому)
ОЭО>0
– ков. пол.(общая электронная пара
смещается к более электроотрицательному
атому)
Металлическая связь – в узлах кристаллической решетки металлов находятся атомы-ионы, между ними свободно перемещаются общие электроны.
Метод валентных связей. Сущ. 2 теории, объясняющие образование ковалентной связи:
1 – метод валентных связей(ВС)
2 – метод молекулярных орбиталей (МОЛКАО)
Основные положения метода ВС:
-
при сближении атомов , между ними возникает химическая связь за счёт образования общих электронных пар. Такую двухэлектронную, двухцентровую связь обозначат валентным штрихом (-).
-
Общая электронная пара образуется при перекрывании электронных орбиталей взаимодействующих атомов.
-
Неспаренные электроны, образующие связь, должны иметь противоположно направленные спины.
Механизм образования ковалентной связи :
А) – обменный механизм – каждый из взаимодействующих атомов предоставляет по одному электрону.
Б) – донорно-акцепторный механизм – один атом предоставляет пару элетронов в общее пользование(донор), а другой свободную орбиталь – акцептор.
Свойства ковалентной связи.
-
– к.с. насыщаема, т. к. она образуется за счёт неспаренных электронов, число к-ых в атоме ограничено.
-
– направленность – ков. связь направлена, т. к. в молекуле связи располагаются друг с другом под определённым углом, следовательно перекрывание орбиталей взаимодействия атомов будет происходить под соответствующим углом. В зависимости от способа перекрывания и симметрии орбитали в пространстве различают
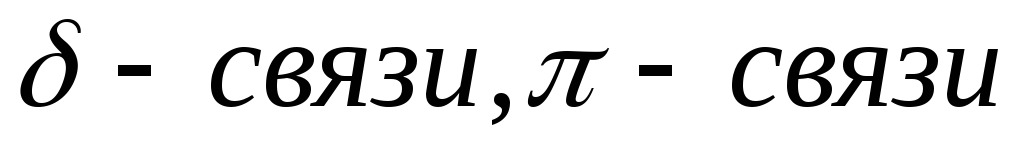 .
Сигма образуются, если перекрывание
орбиталей взаимодействующих атомов
происходит по линии, связывающей центры
атомов. Пи связи образуются, если
перекрывание орбиталей взаимодействующих
атомов происходит по обе стороны от
линии, связывающей центры атомов.
.
Сигма образуются, если перекрывание
орбиталей взаимодействующих атомов
происходит по линии, связывающей центры
атомов. Пи связи образуются, если
перекрывание орбиталей взаимодействующих
атомов происходит по обе стороны от
линии, связывающей центры атомов.
18. Ионная связь как предельный случай ковалентной полярной связи, ее особенности.
Ионная – образуется за счёт электростатического притяжения противоположно заряженных ионов. Ионы образуются за счёт отдачи или принятия электронов.
Ионная связь имеет место при взаимодействии металлов первой группы главной подгруппы(щелочные металлы) и второй группы главной подгруппы с элементами седьмой группы главной подгруппы(галогены).
Здесь ЭО>2.
Ионная связь возникает в результате полного перехода валентных электронов от металла неметаллу. В результате каждый элемент получает законченную электронную оболочку до благородных газов.
Свойства:
-
Ионная связь ненасыщенная. Каждый ион окружён электростатичексим полем, сферичексой симметрией. Ионная связь ненасыщаема, т. к. каждый ион притягивает к себе противоион, сохраняя способность притягивать другие противоионы, т. к. не все силы электрического поля компенсированы.
-
Ионная связь ненаправленная, т.к. каждый ион притягивает к себе противоион по одному направлению.
