- •Е. В. Ванчикова, м. А. Рязанов,
- •В. В. Сталюгин
- •Практические работы
- •По физической химии
- •Содержание
- •Числа переноса ионов Электролиз и числа переноса
- •Работа 1 определение чисел переноса ионов в растворе серной кислоты выполнение измерений
- •1 Подготовка медного кулонометра
- •1.1 Подготовка катода
- •2 Приготовление растворов
- •3 Электролиз водного раствора серной кислоты
- •4 Определение количества эквивалентов кислоты в анодном и катодном пространстве
- •4.1 Титрование растворов серной кислоты
- •4.2 Расчет изменения количества кислоты в растворах
- •5 Оценка значения числа переноса сульфат-ионов
- •Работа 2 определение чисел переноса ионов
- •3 Электролиз водного раствора гидроксида натрия
- •4 Определение количества эквивалентов гидроксида натрия в анодном и катодном пространстве
- •4.1 Титрование растворов гидроксида натрия
- •4.2 Расчет изменения количества гидроксида натрия в растворах
- •5 Оценка значения числа переноса ионов натрия
- •Поляризация молекул и молекулярная рефракция
- •1 Законы поляризации молекул
- •2 Рефракция
- •2.1 Аддитивность рефракции
- •2.2 Рефракция растворов
- •3 Показатель преломления
- •4 Молекулярная рефракция раствора
- •5 Дисперсия молярной рефракции
- •Работа 3 опредение рефракции органических соединений выполнение измерений
- •4.2 Измерение показателя преломления вещества
- •4.3 Расчет молекулярной рефракции вещества
- •Работа 4 Определение молекулярной рефракции растворов и оценка эффективного радиуса молекулы растворенного вещества
- •Выполнение измерений
- •1 Приготовление растворов
- •2 Измерение плотности растворов
- •3 Измерение показателя преломления растворов
- •4 Математическая обработка результатов измерений
- •Работа 5 Анализ смеси углеводородов по относительной дисперсии молекулярной рефракции
- •1 Приготовление растворов и измерение показателя преломления
- •2 Оценка значений коэффициентов градуировочной функции
- •3 Определение массовой доли ароматического углеводорода
- •Кинетика гомогенных химических реакций
- •1 Определение молярной концентрации ионов железа (III)
- •2 Определение частного порядка реакции по отношению к ионам железа (III)
- •2.1 Приготовление растворов
- •2.2 Исследование кинетики реакции
- •3 Определение частного порядка по отношению к йодид-ионам
- •3.1 Приготовление растворов
- •3.2 Исследование кинетики реакции
- •3.3 Расчет частного порядка реакции по отношению к йодид-ионам
- •14 Определение порядка реакции окисления йодид-ионов ионами железа (III)
- •Работа 7 Гидролиз сложного эфира в щелочном растворе
- •1 Приготовление раствора гидроксида натрия
- •2 Подготовка вспомогательных средств
- •3 Изучение кинетики реакции
- •3 Математическая обработка результатов исследования системы, в которой с(r1coor2) с(NaOh)
- •3.1 Расчет молярной концентрации исходных веществ и продуктов реакции
- •3.2 Расчет константы скорости реакции
- •4.1 Расчет молярной концентрации исходных веществ и продуктов реакции
- •4.2 Расчет константы скорости реакции
- •Работа 8 определение константы скорости и энергии активации реакции ГидролизА сложного эфира кондуктометрическим методом
- •1 Оценка значения характеристики ячейки кондуктометра
- •1 Измерение
- •3 Измерение электропроводности исследуемой системы
- •5 Расчет равновесных концентраций компонентов смеси и константы скорости реакции
- •Кинетика гомогенных каталитических химических реакций Работа 9 Определение константы скорости и энергии активации реакции гидролиза сложного эфира в присутствии кислоты
- •Выполнение измерений
- •1 Приготовление раствора сильной кислоты
- •2 Определение молярной концентрации эфира в исследуемой системе
- •3 Определение константы скорости реакции гидролиза сложного эфира при т 30 с
- •4 Определение константы скорости реакции гидролиза сложного эфира при т 45 с
- •4 Оценка энергии активации реакции гидролиза сложного эфира в водном растворе
- •Работа 10 Изучение кинетики реакции гидролиза сахарозы (тростникового сахара)
- •1 Поляризация излучения
- •2 Зависимость угла вращения плоскости поляризации поляризованного излучения от молярной концентрации оптически активного соединения
- •3 Поляриметр
- •1 Определение нулевого положения анализатора
- •2 Приготовление растворов сахарозы и измерение угла вращения
- •2.1 Приготовление и исследование водного раствора сахарозы
- •2.1 Приготовление и исследование кислого раствора сахарозы
- •3 Математическая обработка результатов измерений
- •4 Каталитическая активность кислот
- •Работа 11 Изучение скорости разложения мурексида. Определение константы диссоциации слабой кислоты
- •1 Изучение оптимальных условий измерения оптической плотности растворов
- •1.3 Приготовление рабочего раствора индикатора
- •2 Изучение кинетики разложения мурексида в присутствии сильной кислоты
- •2.1 Приготовление растворов сильной кислоты
- •2.2 Кинетические измерения для реакции разложения мурексида
- •2.3 Расчет константы скорости реакции
- •2.3.2 Метод наименьших квадратов
- •2.4 Оценка значений ko, kH
- •3 Изучение кинетики разложения мурексида в присутствии слабой кислоты
- •3.1 Приготовление растворов слабой кислоты
- •3.2 Кинетические измерения
- •4 Оценка значения константы диссоциации слабой кислоты
- •Работа 12 Йодирование ацетона в кислой среде
- •Выполнение измерений
- •1 Вспомогательные растворы
- •2 Приготовление реакционной смеси
- •3 Определение молярной концентрации эквивалента кислоты в растворе
- •4 Определение молярных концентраций ацетона и йодацетона
- •5 Расчет константы скорости реакции
- •5.1 Расчетный способ
- •5.2 Метод наименьших квадратов
- •Влияние ионной силы на кинетику ионных реакций
- •1 Приготовление раствора индикатора
- •2 Приготовление щелочных растворов соли с различной ионной силой
- •3 Измерение оптической плотности исследуемых растворов индикатора с электролитом
- •4 Математическая обработка результатов измерений
- •4.1 Расчет констант скорости реакции
- •4.2 Расчет ионной силы раствора
- •4.3 Расчет значения параметра а уравнения Дебая – Хюккеля
- •Равновесия в растворах
- •Выполнение измерений
- •1 Приготовление растворов
- •1.1 Основной раствор индикатора
- •1.2 Растворы индикатора, имеющие различное значение рН
- •3 Математическая обработка результатов измерений
- •3.1 Определение числа поглощающих частиц в растворе по числу изобестических точек
- •3.2 Оценка значения константы диссоциации органического реагента
- •Работа 15 Определение рН образоваНия гидроксида металла и его произведения растворимости
- •1 Определение значения рНо
- •1.1 Измерение рН растворов
- •2 Математическая обработка результатов измерений
- •2.1 Определение пр по значению рНо
- •Литература
- •167982, Г. Сыктывкар, ул. Коммунистическая, д. 28
3 Математическая обработка результатов измерений
3.1 Определение числа поглощающих частиц в растворе по числу изобестических точек
На одном рисунке изображают 9 спектров растворов индикатора при различных рН.
Находят длины волн, соответствующие изобестическим точкам.
Число поглощающих частиц на единицу больше числа изобестических точек.
3.2 Оценка значения константы диссоциации органического реагента
3.2.1Оценивают значение константы диссоциации органического реагента алгебраическим методом.
3.2.2 Оценивают значение константы диссоциации органического реагента графическим методом.
3.2.3 Оценивают значимость расхождения измеренных значений константы диссоциации органического реагента (таблица 14.2).
Таблица 14.2 – Измеренные значения константы диссоциации органического индикатора
|
Метод |
Константа диссоциации |
Среднее значение |
Стандартное отклонение |
Расхождение | |
|
фактическое |
допустимое | ||||
|
|
K |
|
|
| |
|
|
Графический |
|
|
|
|
|
|
Расчетный |
|
|
| ||
Работа 15 Определение рН образоваНия гидроксида металла и его произведения растворимости
Количественно данная задача решается только для разбавленных растворов. Если предположить, что недиссоциированный гидроксид металла М(ОН)n в растворе находится в равновесии с ионами по схеме:
М(ОН)n Mn+ + nOH-, (173)
то:
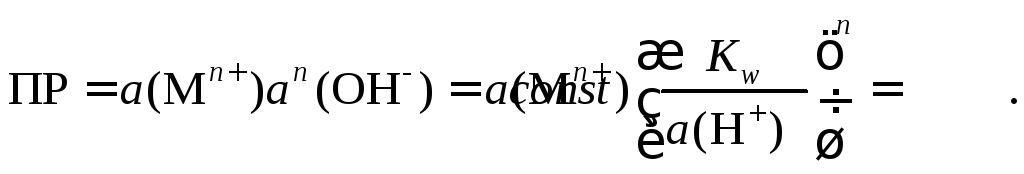 (174)
(174)
Логарифмируя это уравнение, получаем:
![]() ,
(175)
,
(175)
![]() ,
(176)
,
(176)
![]() ,
(177)
,
(177)
где ПР – произведение растворимости гидроксида, моль3/(дм3)3;
Кw – ионное произведение воды, моль2/(дм3)2;
![]() –активности ионов
в растворе, моль/дм3.
–активности ионов
в растворе, моль/дм3.
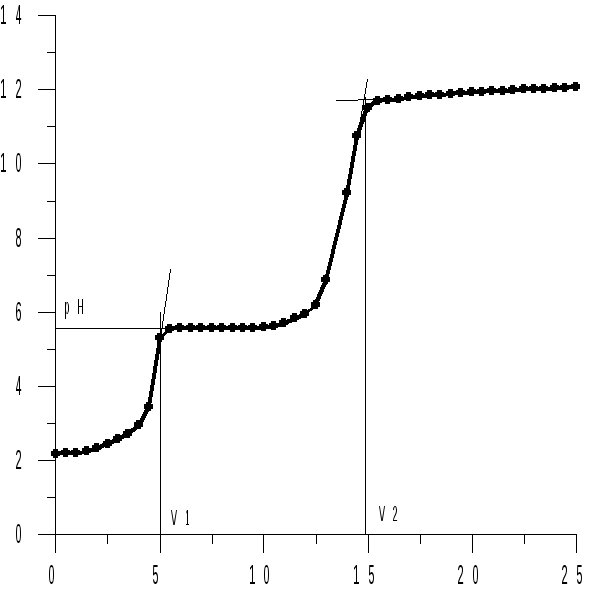
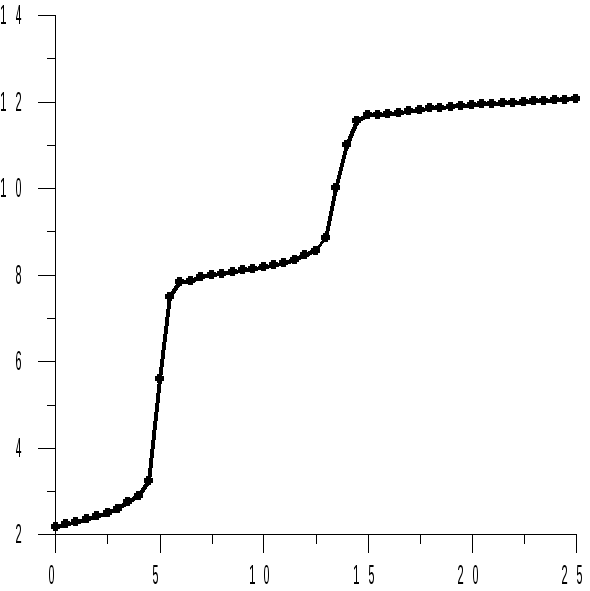
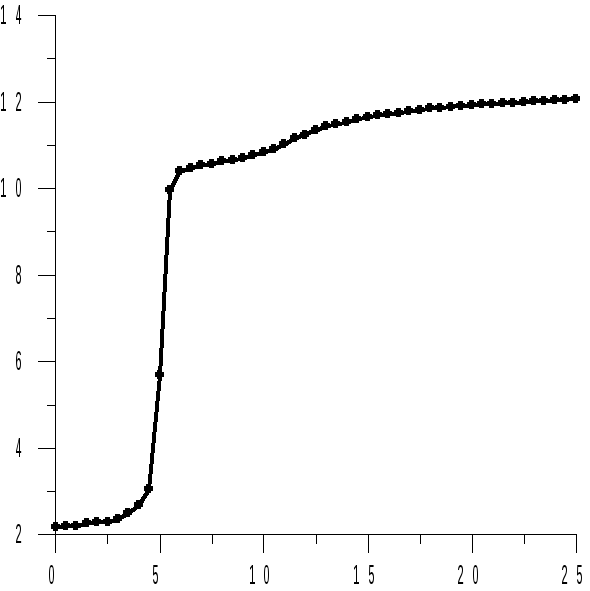
Величина рНo называется стандартным рН образования гидроксида металла. Из этого уравнения следует, что при появлении в растворе осадка гидроксида металла, рН раствора становится слабо зависящей функцией логарифма активности ионов металла, поскольку с этого момента весь добавляемый в раствор гидроксид щелочного металла расходуется на образование малорастворимого гидроксида металла, а не на изменение рН раствора (рисунок 15.1).
|
рН а CuSO4
V, см3 |
рН б CoSO4
V, см3 |
рН в МgSO4
V, см3 |
|
Рисунок 15.1 – Кривые титрования 30 см3 раствора серной кислоты и сульфата металла (II) раствором гидроксида натрия | ||
Таблица 15.1 –
Значения рПР малорастворимых гидроксидов
двухвалентных металлов М(OH)2
рПР Cu(OH)2 19.08 Mg(OH)2 9.22 Mn(OH)2 12.72 Ni(OH)2 14.89 Co(OH)2 14.20 Pb(OH)2 15.28 Cd(OH)2 13.66 Zn(OH)2 16.86
На рисунке 15.1 представлены кривые титрования кислых растворов сульфатов металлов (II), растворимость гидроксидов которых различна. Первый участок (до V1) соответствует взаимодействию гидроксида натрия с кислотой, присутствующей в растворе. Далее идет осаждение ионов металла (от V1 до V2) и только вблизи точки практически полного осаждения ионов металла рН раствора быстро возрастает при добавлении к нему раствора гидроксида натрия. После осаждения гидроксида металла рН раствора изменяется медленно.
Выполнение измерений