
- •Е. В. Ванчикова, м. А. Рязанов,
- •В. В. Сталюгин
- •Практические работы
- •По физической химии
- •Содержание
- •Числа переноса ионов Электролиз и числа переноса
- •Работа 1 определение чисел переноса ионов в растворе серной кислоты выполнение измерений
- •1 Подготовка медного кулонометра
- •1.1 Подготовка катода
- •2 Приготовление растворов
- •3 Электролиз водного раствора серной кислоты
- •4 Определение количества эквивалентов кислоты в анодном и катодном пространстве
- •4.1 Титрование растворов серной кислоты
- •4.2 Расчет изменения количества кислоты в растворах
- •5 Оценка значения числа переноса сульфат-ионов
- •Работа 2 определение чисел переноса ионов
- •3 Электролиз водного раствора гидроксида натрия
- •4 Определение количества эквивалентов гидроксида натрия в анодном и катодном пространстве
- •4.1 Титрование растворов гидроксида натрия
- •4.2 Расчет изменения количества гидроксида натрия в растворах
- •5 Оценка значения числа переноса ионов натрия
- •Поляризация молекул и молекулярная рефракция
- •1 Законы поляризации молекул
- •2 Рефракция
- •2.1 Аддитивность рефракции
- •2.2 Рефракция растворов
- •3 Показатель преломления
- •4 Молекулярная рефракция раствора
- •5 Дисперсия молярной рефракции
- •Работа 3 опредение рефракции органических соединений выполнение измерений
- •4.2 Измерение показателя преломления вещества
- •4.3 Расчет молекулярной рефракции вещества
- •Работа 4 Определение молекулярной рефракции растворов и оценка эффективного радиуса молекулы растворенного вещества
- •Выполнение измерений
- •1 Приготовление растворов
- •2 Измерение плотности растворов
- •3 Измерение показателя преломления растворов
- •4 Математическая обработка результатов измерений
- •Работа 5 Анализ смеси углеводородов по относительной дисперсии молекулярной рефракции
- •1 Приготовление растворов и измерение показателя преломления
- •2 Оценка значений коэффициентов градуировочной функции
- •3 Определение массовой доли ароматического углеводорода
- •Кинетика гомогенных химических реакций
- •1 Определение молярной концентрации ионов железа (III)
- •2 Определение частного порядка реакции по отношению к ионам железа (III)
- •2.1 Приготовление растворов
- •2.2 Исследование кинетики реакции
- •3 Определение частного порядка по отношению к йодид-ионам
- •3.1 Приготовление растворов
- •3.2 Исследование кинетики реакции
- •3.3 Расчет частного порядка реакции по отношению к йодид-ионам
- •14 Определение порядка реакции окисления йодид-ионов ионами железа (III)
- •Работа 7 Гидролиз сложного эфира в щелочном растворе
- •1 Приготовление раствора гидроксида натрия
- •2 Подготовка вспомогательных средств
- •3 Изучение кинетики реакции
- •3 Математическая обработка результатов исследования системы, в которой с(r1coor2) с(NaOh)
- •3.1 Расчет молярной концентрации исходных веществ и продуктов реакции
- •3.2 Расчет константы скорости реакции
- •4.1 Расчет молярной концентрации исходных веществ и продуктов реакции
- •4.2 Расчет константы скорости реакции
- •Работа 8 определение константы скорости и энергии активации реакции ГидролизА сложного эфира кондуктометрическим методом
- •1 Оценка значения характеристики ячейки кондуктометра
- •1 Измерение
- •3 Измерение электропроводности исследуемой системы
- •5 Расчет равновесных концентраций компонентов смеси и константы скорости реакции
- •Кинетика гомогенных каталитических химических реакций Работа 9 Определение константы скорости и энергии активации реакции гидролиза сложного эфира в присутствии кислоты
- •Выполнение измерений
- •1 Приготовление раствора сильной кислоты
- •2 Определение молярной концентрации эфира в исследуемой системе
- •3 Определение константы скорости реакции гидролиза сложного эфира при т 30 с
- •4 Определение константы скорости реакции гидролиза сложного эфира при т 45 с
- •4 Оценка энергии активации реакции гидролиза сложного эфира в водном растворе
- •Работа 10 Изучение кинетики реакции гидролиза сахарозы (тростникового сахара)
- •1 Поляризация излучения
- •2 Зависимость угла вращения плоскости поляризации поляризованного излучения от молярной концентрации оптически активного соединения
- •3 Поляриметр
- •1 Определение нулевого положения анализатора
- •2 Приготовление растворов сахарозы и измерение угла вращения
- •2.1 Приготовление и исследование водного раствора сахарозы
- •2.1 Приготовление и исследование кислого раствора сахарозы
- •3 Математическая обработка результатов измерений
- •4 Каталитическая активность кислот
- •Работа 11 Изучение скорости разложения мурексида. Определение константы диссоциации слабой кислоты
- •1 Изучение оптимальных условий измерения оптической плотности растворов
- •1.3 Приготовление рабочего раствора индикатора
- •2 Изучение кинетики разложения мурексида в присутствии сильной кислоты
- •2.1 Приготовление растворов сильной кислоты
- •2.2 Кинетические измерения для реакции разложения мурексида
- •2.3 Расчет константы скорости реакции
- •2.3.2 Метод наименьших квадратов
- •2.4 Оценка значений ko, kH
- •3 Изучение кинетики разложения мурексида в присутствии слабой кислоты
- •3.1 Приготовление растворов слабой кислоты
- •3.2 Кинетические измерения
- •4 Оценка значения константы диссоциации слабой кислоты
- •Работа 12 Йодирование ацетона в кислой среде
- •Выполнение измерений
- •1 Вспомогательные растворы
- •2 Приготовление реакционной смеси
- •3 Определение молярной концентрации эквивалента кислоты в растворе
- •4 Определение молярных концентраций ацетона и йодацетона
- •5 Расчет константы скорости реакции
- •5.1 Расчетный способ
- •5.2 Метод наименьших квадратов
- •Влияние ионной силы на кинетику ионных реакций
- •1 Приготовление раствора индикатора
- •2 Приготовление щелочных растворов соли с различной ионной силой
- •3 Измерение оптической плотности исследуемых растворов индикатора с электролитом
- •4 Математическая обработка результатов измерений
- •4.1 Расчет констант скорости реакции
- •4.2 Расчет ионной силы раствора
- •4.3 Расчет значения параметра а уравнения Дебая – Хюккеля
- •Равновесия в растворах
- •Выполнение измерений
- •1 Приготовление растворов
- •1.1 Основной раствор индикатора
- •1.2 Растворы индикатора, имеющие различное значение рН
- •3 Математическая обработка результатов измерений
- •3.1 Определение числа поглощающих частиц в растворе по числу изобестических точек
- •3.2 Оценка значения константы диссоциации органического реагента
- •Работа 15 Определение рН образоваНия гидроксида металла и его произведения растворимости
- •1 Определение значения рНо
- •1.1 Измерение рН растворов
- •2 Математическая обработка результатов измерений
- •2.1 Определение пр по значению рНо
- •Литература
- •167982, Г. Сыктывкар, ул. Коммунистическая, д. 28
2 Подготовка вспомогательных средств
Ставят в кристаллизатор со льдом в стакане не менее 300 см3 дистиллированной воды для охлаждения.
В шесть конических колб вместимостью 250 см3 помещают по
10 см3 раствора хлороводородной кислоты (с(H+) = 0.05 моль/дм3) и по 34 капли фенолфталеина.
Заполняют бюретку раствором гидроксида натрия
(c(ОH-) = 0.02 моль/дм3).
Моют и высушивают мерную пипетку вместимостью 1 см3.
Моют мерный цилиндр вместимостью 25 см3.
3 Изучение кинетики реакции
Так как гидролиз сложного эфира в щелочной среде протекает очень быстро, все дальнейшие процедуры проводят быстро.
3.1 В мерную колбу вместимостью 250 см3 наливают до метки приготовленный раствор гидроксида натрия и переносят его количественно в коническую колбу вместимостью 300 500 см3 с притертой крышкой.
3.2 В коническую колбу с приготовленным раствором гидроксида натрия (п. 3.1) мерной пипеткой вместимостью 1 см3 вносят аликвотную часть сложного эфира (таблица 7.2) раствор перемешивают.
Включают секундомер.
3.3 Отбирают мерным цилиндром вместимостью 25 см3 аликвотную часть реакционной смеси 20 см3 (или 10 см3, смотри п. 2) и переносят её в первую коническую колбу с хлороводородной кислотой.
Добавляют другим мерным цилиндром 20 см3 охлажденной дистиллированной воды.
Засекают время, прошедшее от начала реакции.
Титруют систему раствором гидроксида натрия до окрашивания всего объема раствора в розовый цвет от одной добавленной капли раствора гидроксида натрия. Измеряют объем раствора гидроксида натрия, пошедший на титрование.
Окраска раствора исчезает через 2 3 с. Если окраска раствора исчезает более чем через 5 секунд, раствор перетитрован.
3.4 Сразу приступают к подготовке и титрованию второй аликвотной части системы, повторяя все процедуры п. 3.3.
Процедуры п. 3.3 повторяют непрерывно с остальными порциями растворов кислоты и исследуемой системы.
3.5 Оставшуюся часть исследуемой системы помещают в термостат не менее чем на 60 минут при Т 60 С.
З
V,
см3
t,
с
Рисунок 7.1 –
Зависимость объема раствора гидроксида
натрия, пошедшего на титрование
аликвотной части исследуемой системы,
от времени протекания реакции 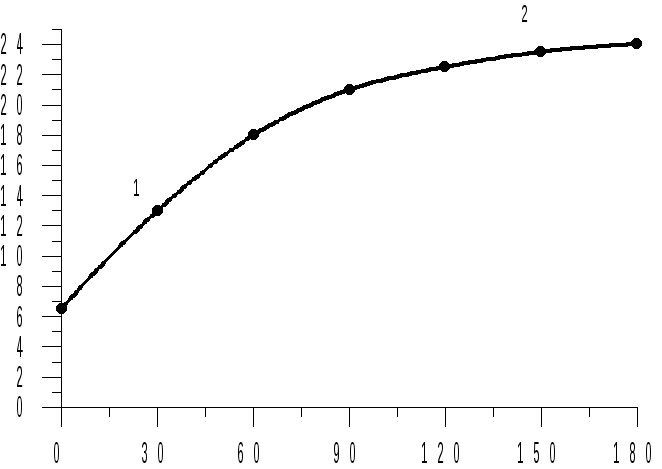
3.6 Строят зависимость объема раствора гидроксида натрия, пошедшего на титрование, от времени протекания реакции (рисунок 7.1).
3.7 Если на участке 1 кривой рисунка 7.1 оказалось менее трех точек, все процедуры п. 3.1 3.4 повторяют быстрее.
3 Математическая обработка результатов исследования системы, в которой с(r1coor2) с(NaOh)
3.1 Расчет молярной концентрации исходных веществ и продуктов реакции
Обозначим:
a – исходная молярная концентрация гидроксида натрия в исследуемой системе, моль/дм3;
b – исходная молярная концентрация сложного эфира в исследуемой системе, моль/дм3;
x – молярная концентрация ацетата натрия в момент времени t, моль/дм3;
Va – аликвотная часть исследуемой системы, взятая для титрования t, см3;
Vo – объем раствора гидроксида натрия, пошедший на титрование избытка кислоты, добавленной к аликвотной части исследуемой системы в момент времени t = 0, см3;
Vt – объем раствора гидроксида натрия, пошедший на титрование избытка кислоты, добавленной к аликвотной части исследуемой системы в момент времени t, см3;
V – объем раствора гидроксида натрия, пошедший на титрование избытка кислоты, добавленной к аликвотной части исследуемой системы после окончания реакции, см3;
сщ – молярная концентрация гидроксида натрия в титранте, моль/дм3.
Vк – объем раствора кислоты, добавленный к пробе, см3;
с(Н+) – молярная концентрация эквивалента кислоты в исходном растворе, моль/дм3.
Рассчитывают молярные концентрации всех участников реакции (таблица 7.2), исходя из следующих соотношений:
(87)
(88)
(89)

Изображают зависимости молярных концентраций всех участников реакции от времени.
Таблица 7.2 – Молярные концентрации сложного эфира, гидроксида натрия, ацетата натрия и этилового спирта
|
Время |
Объем титранта |
Молярные концентрации с(Х), моль/дм3 |
Константа скорости реакции, с-1моль-1дм3 | |||||
|
t, с |
Vщ, см3 |
R1COOR2 |
NaOH |
R1COONa |
R2OH |
k |
|
|
