
- •Дополнительные материалы для подготовки к занятию по теме: «Общая нозология. Повреждение» Общие понятия
- •Адаптация и повреждение
- •Повреждение
- •Гибель клеток
- •Клеточные дистрофии
- •Старение клеток
- •Сосудистая реакция
- •Клеточная реакция
- •Повреждение, индуцированное активированными лейкоцитами
- •Исходы острого воспаления
- •Репарация
- •Хроническое воспаление
Повреждение
Повреждение клеток – нарушение функции, гомеостаза и структуры клеток; возникает тогда, когда повреждающий стимул (по природе, силе, продолжительности) таков, что к нему невозможна адаптация. Обратимое повреждение приводит к восстановлению нарушенных параметров после удаления повреждающего стимула. При обратимом повреждении, как правило, нет существенных нарушений плазматической мембраны и ядра. Необратимое повреждение приводит к гибели клеток путем некроза (одна из двух форм гибели клеток наряду с апоптозом). Переход от обратимого повреждения к необратимому, как правило, сопровождается двумя событиями: 1) невозможностью восстановления функции митохондрий и аэробного метаболизма, 2) нарушением плазматической мембраны. Основные причины повреждения клеток: гипоксия, ишемия, внешние химические и физические агенты, инфекции, воспаление и иммунные реакции, генетические дефекты, нарушения питания, старение.
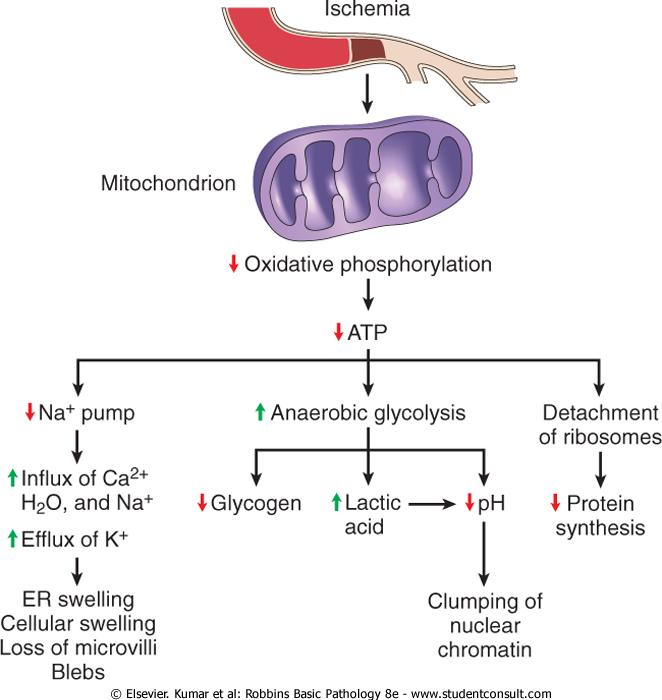
Механизмы повреждения. Наиболее уязвимые для повреждающих стимулов субклеточные мишени: мембрана, цитоскелет, митохондрии (генерация АТФ), генетический аппарат, синтез белков (рис.):

Дефицит АТФ как механизм повреждения особенно выражен в органах с низкой способностью к гликолизу (головной мозг, миокард) и меньше – в органах с высокой гликолитической способностью (печень). Возникает при ↓ АТФ до уровня 5-10%. Основные пути развития (рис.):
↓ АТФ-зависимого трансмембранного транспорта ионов → изменения ионного состава → набухание клеток, ЭПС, потеря микроворсинок;
↑ гликолиза → ↓рН → конденсация хроматина, ингибирование ферментов, в т.ч., обратное ингибирование гликолиза и усиление энергодефицита;
отсоединение рибосом от ЭПС → ↓синтеза белков.
Дефект митохондрий как механизм повреждения возникает за счет повышения [Ca2+]i, активных метаболитов, или форм, кислорода (reactive oxygen species, ROS). При потере мембранного потенциала митохондрий снижается выработка АТФ, а выход митхондриальных белков (! – цитохром с) в цитоплазму запускает апоптоз (см. далее).
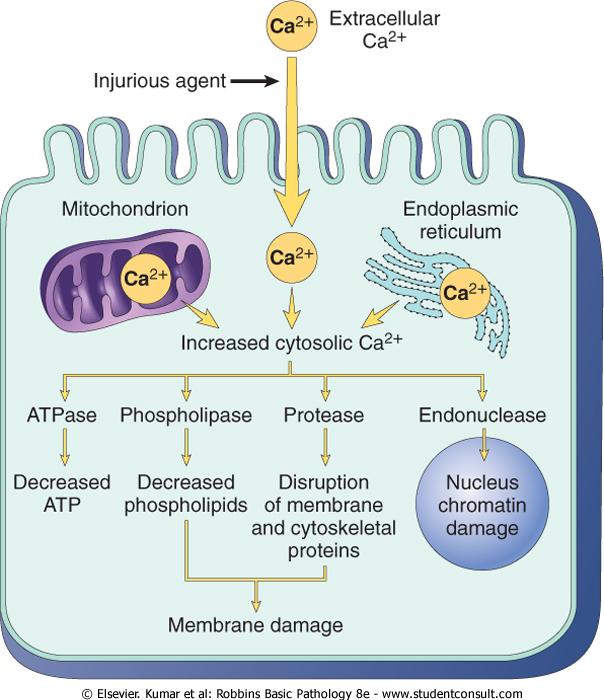
Повышение внутриклеточной концентрации кальция. Вход Са2+ в цитоплазму (сначала из внутриклеточных депо, затем извне) происходит при неспособности поддерживать [Ca2+]i белками-переносчиками (Са-АТФаза, Na-Ca обменник, опосредовано - Na,K-АТФаза). В этих условиях активируются Са-зависимые ферменты, которые повреждают субклеточные структуры и вызывают дополнительный расход АТФ (рис.), кроме того, изменяется мембранный потенциал, и происходит электрическое разобщение клеток (за счет изменения свойств межклеточных контактов).
Окислительный стресс – состояние с повышением [ROS] (ROS = reactive oxygen species, активные метаболиты кислорода, активные формы кислорода) внутри клетки за счет усиления их генерации или уменьшения их удаления антиоксидантами. ROS очень активны, атакуют ДНК, РНК, белки, жирные кислоты с образованием новых свободных радикалов (R∙). ROS образуются постоянно в митохондриях при дыхании, но разрушаются антиоксидантами.
Генерация ROS:
Неполное восстановление О2 в дыхательной цепи – образование О2-∙, Н2О2, ОН∙
Образование ROS с участием металлов, например, реакция Фентона: Fe2+ + H2O2 → Fe3+ + OH∙ + OH-
Поглощение лучевой энергии (УФ, рентген) – гидролиз: Н2О → ОН∙ +Н∙
Ферментативный метаболизм экзогенных веществ (CCl4)
Образование лейкоцитами при воспалении
NO – образование лейкоцитами при воспалении и эндотелием
Удаление ROS (антиоксиданты):
Супероксиддисмутаза – 2О2-∙ +2Н → Н2О2 + О2
Глутатионпероксидаза – 2OH∙ + 2GSH → 2Н2О + GSSG. Отношение [GSSG]/[GSH] показывает окислительное состояние клетки и способность катаболизировать свободные радикалы.
Каталаза в пероксисомах – 2Н2О2 → О2 + Н2О
Витамины Е, А, С - ↓ образования ROS, ↑ удаления ROS
Трансферрин, ферритин, лактоферрин, церулоплазмин – связывание Fe и Cu, способствующих генерации ROS по реакции Фентона
Эффекты ROS:
Перекисное окисление липидов (ПОЛ) – образование пероксидов;
Образование перекрестных связей между белками через SH-группы; фрагментация белков;
Фрагментация ДНК (реакция с тимином)
Мембранные дефекты как отдельный механизм повреждения возникают при действии ROS, дефиците АТФ, кальциевой перегрузке. Продукты распада фосфолипидов (неэстерифицированные жирные кислоты, ацилкарнитин, лизофосфолипиды) могут встраиваться в мембрану и растворять ее (детергентный эффект). При дефекте мембран митохондрий снижается выработка АТФ, при дефекте плазматической мембраны нарушается осмотический баланс и теряются метаболиты, а при дефекте мембран лизосом происходит утечка кислых гидролаз (РНКазы, ДНКазы, протеазы, гликозидазы), в результате чего разрушаются другие клеточные структуры.
Существуют тканеспецифические признаки повреждения. Наличие в сыворотке компонентов внутриклеточного содержимого (ферменты, белки сократительного аппарата, миоглобин) свидетельствует о мембранных дефектах (некрозе): тропонин (Т и I) – кардиомиоциты, щелочная фосфатаза – эпителий желчных протоков, трансаминазы – гепатоциты.
