
XAXANINA
.pdf
Работа № 10 Определение рН воды
При определении рН методом нейтрализации наиболее применимы индикаторы:
метиловый оранжевый, метиловый красный, лакмус и фенолфталеин. Поведение их уп-
рощенно объясняет ионная теория индикаторов.
Согласно этой теории, индикаторы - слабые органические кислоты (или слабые ос-
нования), у которых недиссоциированные молекулы и образуемые ими ионы имеют раз-
личную окраску. Поэтому они носят общее название кислотно-основных индикаторов.
Если обозначить молекулы фенолфталеина через HInd, а его анионы - через Ind–, то
уравнение диссоциации имеет вид:
HInd H+ + Ind ‾.
бесцветный малиновый
Если к этому раствору прибавить какую-нибудь сильную кислоту (или внести фе-
нолфталеин в раствор кислоты), равновесие диссоциации его сместится влево, Н+-ионы сильной кислоты почти полностью свяжут окрашенные ионы Ind – в бесцветные молекулы
HInd, и раствор обесцветится. Если же к раствору фенолфталеина прибавить щелочь (или внести фенолфталеин в раствор щелочи), то ее ОН–-ионы будут связывать Н+-ионы фе-
нолфталеина, равновесие сместится вправо, в сторону увеличения ионов Ind –, и раствор окрасится в малиновый цвет.
Каждый индикатор меняет окраску раствора в характерном для него интервале значений рН, который называется областью перехода индикатора. Так, в присутствии фе-
нолфталеина раствор бесцветен при рН ≤ 8 и имеет интенсивно-малиновую окраску при рН ≥ 10. Область перехода фенолфталеина лежит в интервале рН, равном 8 - 10, т.е. в
щелочной среде.
На рис.5 показано изменение окраски метилового оранжевого и фенолфталеина при различных значениях рН.
Метиловый |
|
|
|
|
|
|
|
|
|
|
|
|
|
оранжевый |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Розовая |
|
|
Желтая |
|
8 |
9 |
10 |
11 |
12 |
13 |
14 |
|
|
|
|
|
|
|
|
|||||||
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
|
|
|
|
pH |
|
|
Малиновая |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||
Фенолфталеин |
|
|
|
Бесцветная |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|||
Рис.5. Окраска метилового оранжевого и фенолфталеина при различных значениях рН. 
 - область перехода индикатора
- область перехода индикатора
61
Для приблизительного определения pH удобно пользоваться так называемым уни-
версальным индикатором, представляющим собой смесь нескольких индикаторов, изме-
няющих окраску раствора в широком интервале рН. Бумага, пропитанная универсальным индикатором, называется универсальной индикаторной бумагой. К пачке такой бумаги прилагается цветная шкала, показывающая, какие окраски принимает индикаторная бума-
га при различных величинах рН нанесенного на нее раствора.
Оборудование и реактивы
Индикаторы: лакмус, фенолфталеин, метиловый оранжевый, метиловый красный,
универсальная индикаторная бумага.
Растворы: соляной кислоты (0,1 н, 1 н); гидроксида натрия (0,1 н, 1 н).
Иономер.
Буферные растворы с номинальными значениями рН = 1,65; 4,01; 9,18.
Электрод ионоселективный стеклянный.
Электрод сравнения хлоридсеребряный.
Стаканы стеклянные на 100, 250 мл.
Пробирки 10 шт.
Фильтровальная бумага.
62
А. Определение рН воды с применением индикаторов
Для определения рН в кислой и щелочной средах наиболее часто применяют четы-
ре индикатора: метиловый оранжевый, метиловый красный, лакмус и фенолфталеин. На-
блюдения проведите в сильнокислой и сильнощелочной средах, чтобы в первом случае рН был заведомо ниже, а во втором - заведомо выше рН области перехода указанных индика-
торов. Для этого в четыре пронумерованные пробирки внесите по 10 капель 0,1 н раствора соляной кислоты; в другие четыре пробирки, пронумерованные теми же номерами, - такой же объем 0,01 н раствора гидроксида калия. После этого в пробирки с кислотой и щело-
чью добавьте по 1 капле индикатора метилового оранжевого, метилового красного, лак-
муса (5 капель) и фенолфталеина.
Наблюдения по изменению окраски индикаторов в кислой и щелочной средах за-
пишите в форму табл.9, где уже указаны интервалы рН области перехода каждого индика-
тора и его окраска в этой области.
Форма таблицы 9
Изменение окраски индикаторов
|
|
Окраска индикатора |
||
Индикатор |
рН области перехода |
в кислой |
в области перехода |
в щелочной среде |
|
|
среде |
||
|
|
|
|
|
Метиловый |
3,1 - 4,4 |
|
Оранжевая |
|
оранжевый |
|
|
||
|
|
|
|
|
Метиловый |
4,4 - 6,2 |
|
Оранжевая |
|
красный |
|
|
||
|
|
|
|
|
Лакмус |
5,0 - 8,0 |
|
Фиолетовая |
|
Фенолфталеин |
8,0 - 10,0 |
|
Бледно-малиновая |
|
Получите у преподавателя раствор, рН которого надо определить. С помощью пи-
петки перенесите 2 - 3 капли этого раствора на индикаторную бумагу с универсальным индикатором. Сравните окраску с цветной шкалой и выберите на ней оттенок, наиболее близкий к цвету полученного пятна. Сделайте вывод о рН исследуемого раствора и ука-
жите реакцию среды. Проверьте правильность своего вывода у преподавателя.
Б. Определение рН воды на иономере методом прямой потенциометрии
На иономере рН раствора определяют с точностью до ±0,02 единицы рН. Датчи-
ком, регистрирующим величину рН раствора, является стеклянный электрод, электродом сравнения - хлоридсеребряный.
63
Проверку электродов и настройку иономера проводят по буферным растворам.
Перед началом измерений стеклянный электрод должен быть выдержан не ме-
нее суток в 0,1 М растворе HCl или в дистиллированной воде.
Описание определения
Иономер после включения в сеть и прогревания в течение 30 минут настраивают по двум буферным растворам - в кислой и щелочной областях рН. Для этого в стакан наливают соответствующий буферный раствор, опускают электрод, фиксируют значение рН и, если необходимо, корректируют его с помощью специальной настройки. Перед каждым погру-
жением в буферный или исследуемый раствор электрод тщательно промывают дистиллиро-
ванной водой и оставляют погруженным в воду.
Результаты измерений записывают в тетрадь. По значению рН вычисляют концен-
трацию ионов [H+] и [OH−] в растворе. Полученные результаты cообщают преподавателю.
В. Определение рН воды на иономере методом потенциометрического титрования
Потенциометрическое титрование (ПТ) - регистрация изменения потенциала в про-
цессе химической реакции между определяемым элементом и титрантом. Конечную точку титрования (КТТ) находят по скачку потенциала, отвечающему моменту завершения ре-
акции.
Реакции должны протекать быстро, необратимо, возможно полнее.
В ПТ все реакции делятся на:
1)нейтрализации;
2)окислительно-восстановительные;
3)осаждения и комплексообразования.
Индикаторный электрод выбирают в зависимости от типа химической реакции и природы потенциалопределяющих ионов.
Оборудование и реактивы
Иономер (рН-метр).
Индикаторный электрод стеклянный.
Электрод сравнения хлоридсеребряный.
Стаканы стеклянные на 100, 250 мл.
64
Фильтровальная бумага.
Мешалка магнитная.
Бюретка на 25 мл.
Пипетка на 10 мл,
Гидроксид натрия 0,1000 н. раствор (титр устанавливается по щавелевой кислоте).
Описание определения
Сначала проводят ориентировочное титрование и находят объем титранта, прибли-
зительно соответствующий КТТ, посредством следующих операций.
1.Прибор (рН-метр, иономер) приводят в рабочее состояние согласно описанию.
2.Полученный от преподавателя в мерной колбе анализируемый раствор разбав-
ляют дистиллированной водой до метки и тщательно перемешивают.
3. Аликвотную часть анализируемого раствора переносят пипеткой в стакан вме-
стимостью 100 - 150 мл и, если это предусмотрено методикой , добавляют необходимые реагенты.
4. Стакан с раствором помещают в центр столика для титрования магнитной ме-
шалки, опускают в стакан магнитик-мешалку и электроды (индикаторный и электрод сравнения).
5. Бюретку заполняют раствором титранта (NaOH) и закрепляют в штативе так,
чтобы кончик бюретки был опущен в стакан, но не соприкасался с поверхностью титруе-
мого раствора.
6. Проводят ориентировочное титрование, прибавляя из бюретки по 1,00 мл раствора титранта. После каждой порции включают мешалку для перемешивания раствора и изме-
ряют Е (рН). Отсчеты ЭДС производят только после достижения постоянного значения (из-
менение ЭДС не должно превышать 2 - 3 мВ в течение 1 мин). Титрование продолжают до тех пор, пока изменение ЭДС Е (или рН рН) не достигнет своего максимального значе-
ния, а при дальнейшем прибавлении новых порций раствора титранта постепенно не уменьшится до малой величины.
Определив ориентировочно КТТ, повторяют титрование для получения более точ-
ных данных. Вблизи точки эквивалентности раствор титранта добавляют по 0,2 мл.
Результаты титрования записывают в форму табл.10.
65
|
|
|
|
|
|
|
Форма таблицы 10 |
|
|
|
Результаты титрования |
|
|
|
|||
|
|
|
|
|
|
|
|
|
Номер |
Объем добавляемого |
|
|
E |
|
Концентрация |
|
|
Измеренная ЭДС, В |
|
|
определяемого |
|
||||
п/п |
титранта V, мл |
|
|
V |
|
|
||
|
|
|
|
элемента, г |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
Графические способы определения КТТ |
|||||||
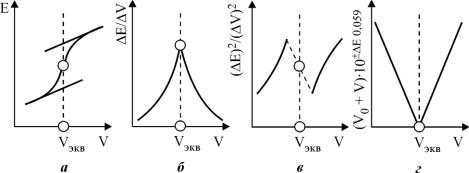
1. Изображают графически зависимость Е (рН) от объема титранта V, т.е. строят ин-
тегральную кривую (рис.6,а). Точка перегиба на кривой отвечает КТТ. Для нахождения точки перегиба проводят две параллельные касательные к пологим верхней и нижней час-
тям кривой и соединяют их прямой таким образом, чтобы точка пересечения ее
Рис.6. Кривые потенциометрического титрования: а - интегральная;
б- дифференциальная; в - по второй производной; г - метод Грана
скривой титрования делила эту прямую на две равные части. Точка пересечения перпендикуляра, опущенного из центра перегиба, с осью абсцисс (осью V - объема титранта) дает объем титранта, отвечающий КТТ.
2. Более простой и точный способ нахождения КТТ - по дифференциальной кри-
вой, т.е. зависимости величин первой производной Е/ΔV от объема прибавленного тит-
ранта V. В этом случае кривая имеет пикообразную форму, максимум которой соответст-
вует КТТ (рис.6,б).
3. В некоторых случаях, например в случае асимметричных кривых титрования или при малом скачке потенциала, для нахождения КТТ следует пользоваться второй производной, т.е. зависимостью (ΔЕ)2/(ΔV)2 от V. Для нахождения КТТ по этой зависимо-
сти соединяют концы обеих ветвей кривой, которые находятся по разные стороны оси абсцисс. Точка пересечения полученной кривой с осью абсцисс дает объем титранта , от-
вечающий КТТ (рис.6,в).
66
В литературе описан ряд других графических способов определения точки эквива-
лентности, например метод Грана. Суть метода заключается в спрямлении кривой титрования, которое достигается при построении графика в координатах (V0 + V)·10±ΔE/0,059 – V,
где V0 - исходный объем анализируемого раствора; V - объем титранта, добавленного к раствору; Е - изменение ЭДС системы (изменение потенциала ΔE индикаторного элек-
трода). Точке эквивалентности соответствует точка пересечения спрямленной ветви кривой титрования с осью абсцисс (рис.6,г).
Определив концентрацию кислого анализируемого раствора, рассчитывают рН рас-
твора.
67

Пример контрольного теста
1. Потенциометрическое титрование нельзя применить при:
1)титровании мутных растворов;
2)отсутствии подходящего индикатора;
3)определении нескольких компонентов;
4)отсутствии индикаторного электрода.
2.Электрод сравнения в рН-метре: 1) хлоридсеребряный; 2) водородный; 3) каломельный; 4) стеклянный.
3.Платиновый электрод служит индикаторным электродом в реакциях: 1) окисления-восстановления; 2) нейтрализации; 3) осаждения;
4) комплексообразования.
4.Укажите уравнение Нернста для серебряного электрода, применяемого при по-
тенциометрическом титровании в качестве индикаторного электрода:
1)E = E0(AgCl↓/Cl–, Ag↓) – 0,059 lg [Cl–];
2)E = E0(Ag+/Ag) + 0,059 lg [Ag+];
3)E = E0(Sb2O3↓, H+/Sb↓,H2O) – 0,059 pH;
4)E = E0(Fe3+/Fe2+) – 0,059 lg [Fe3+]/[Fe2+].
5. рН раствора рассчитывают по формуле:
1)рН = Е0 + RTnF ln [Н+];
2)рН = – lg [Н+];
3)рН = 1/2 lg(Kдис∙С);
4)рН = KН2О/Kдис.
6. При pH = 8,3 лакмус принимает окраску:
1) бесцветную; 2) желтую; 3) красную; 4) синюю.
68
Работа № 11
Определение рН почвы
Повышенная кислотность почвы вредна для большинства сельскохозяйственных растений. Под ее действием в почве гибнут полезные микроорганизмы (клубеньковые бактерии, азотобактерии и др.). Проверяя кислотность почвы, выясняют необходимость ее известкования.
Различают две формы почвенной кислотности: активную и скрытую.
Активная кислотность вызывается присутствием в почвенном растворе свободных ионов H+. Определяют ее по величине pH водной вытяжки из почвы.
Скрытая (потенциальная) кислотность обусловлена ионами H+ и Al3+, поглощен-
ными почвой. В свою очередь она подразделяется на обменную и гидролитическую.
Обменная кислотность проявляется, когда поглощенные почвой ионы H+ и Al3+
обмениваются на катионы негидролизующихся солей и переходят в почвенный раствор.
Гидролиз солей Al3+ еще более повышает кислотность этого раствора. Определяют об-
менную кислотность, измеряя величину pH вытяжки из почвы, приготовленной на водном растворе хлорида калия.
Гидролитическая кислотность обуславливается ионами H+ и Al3+, поглощенными почвой, но переходящими в раствор под действием гидролизующихся солей, образован-
ных щелочными металлами. Определяют ее, измеряя pH вытяжки из почвы, приготовлен-
ной на растворе ацетата натрия CH3COONa.
Вопросы известкования почвы решают главным образом исходя из ее обменной ки-
слотности. При этом определяют pH солевой вытяжки.
При pH от 3 до 5 почвы считаются кислыми, от 5 до 7 - слабокислыми, при pH,
равном 7, - нейтральными и выше 7 - щелочными.
Зная pH почвы, можно приступить к известкованию. В табл.11 приведены нормы вне-
сения молотого известняка при разных значениях pH почвы.
Вместо известняка можно использовать мел, гашеную известь, древесную золу, доло-
митовую муку. Гашеную известь вносят в норме, уменьшенной в 1,35 раза по сравнению с известняком, а золу - из расчета в 2 - 10 раз больше. Мел, доломитовую муку приравнивают к известняку.
69
Таблица 11
Нормы внесения молотого известняка (кг/10 м2) при различных значениях pH почвы
Состав почвы |
|
pH почвы |
|
|
|||
4,5 и меньше |
4,8 |
5,2 |
5,4 - 5,8 |
6,1 - |
6,3 |
||
|
|||||||
Супесчаная и легкосуглинистая |
4 |
3 |
2 |
2 |
- |
|
|
Средне- и тяжелосуглинистая |
6 |
5 |
4 |
3,5 |
3 |
||
Оборудование и реактивы
Индикаторы: лакмус, фенолфталеин, метиловый оранжевый, метиловый красный,
универсальная индикаторная бумага.
Растворы: соляной кислоты (0,1 н, 1 н); гидроксида натрия (0,1 н, 1 н).
Иономер.
Буферные растворы с номинальными значениями рН = 1,65; 4,01; 9,18.
Электрод ионоселективный стеклянный.
Электрод сравнения хлоридсеребряный.
Стаканы стеклянные на 100, 250 мл.
Пробирки 10 шт.
Технические весы.
Хлорид калия, 1 н.
Ацетат натрия, 1 н.
Мерный цилиндр на 100 мл.
Колбы конические на 100 мл.
Установка для фильтрования (колба, воронка, фильтровальная бумага).
Описание определения
Приготовление солевой вытяжки из почвы. Образец почвы рассыпают тонким слоем на листе бумаги, мелкими порциями из разных мест отбирают 20 г и взвешивают на технических весах. Переносят навески почвы в три конические колбы и прибавляют:
-в первую 50 мл дистиллированной воды - для определения активной кислотности;
-во вторую 50 мл 1 н раствора KCl - для определения обменной кислотности;
-в третью 50 мл 1 н раствора CH3COONa - для определения гидролитической ки-
слотности.
70
